Для насыщенных углеводородов характерна структурная изомерия, связанная с разветвлением их углеродной цепи. Структурные изомеры отличаются между собой только порядком размещения атомов углерода в молекуле.
Структурная изомерия насыщенных углеводородов начинается с бутана. Бутан существует в виде двух, пентан - в виде трех изомеров:
Гексан имеет пять структурных изомеров, гептан - девять, октан - $18$ нонан - $35$, декан - $75$ и т. д. Чем больше в молекуле насыщенного углеводорода атомов углерода, тем больше изомеров он образует. Для углеводорода $C_{13}H_{28}$ возможно $802$ изомеров, для $C_{14}H_{30}$ - уже $1858$ изомеров, для $C_{15}H_{32} - 4347$, для $C_{20}H_{42}$ возможные $366319$ изомеров и т. д.
Конформационная изомерия бутана
Молекулу бутана удобно рассматривать как дизамещенный этан. В зависимости от угла поворота заместителей вокруг связи $C2-C3$ различают четыре характеристические конформации:
- полностью заслоненная (син-планарная) - связи $C-H$ и $C-C$ расположены одна за другой, торсионный угол $\varphi = 0^\circ$;
- скошенная (гош- или син-клинальная) - торсионный угол $\varphi = 60^\circ$
- частично в заслоненная (анти-клинальная) - отличается от полностью заслоненной конформации тем, что $C-C$-связи не совпадают, торсионный угол $\varphi -120^\circ$;
- заторможеная (анти-планарная) - торсионный угол $\varphi = 180^\circ$:
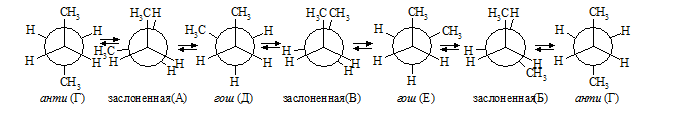
Рисунок 1.
Максимальную потенциальную энергию имеет син-планарная конформация, для которой наряду с торсионным напряжением существует и вандерваальсовы напряжение, возникающее в результате отталкивания групп, в этом случае метильных, которые смещены на расстояние, меньше суммы их вандерваальсовы радиусов.
Минимальная внутренняя энергия характерна для анти-планарной конформации, которая не имеет торсионных напряжений. Барьер ротации для молекулы бутана составляет $26$ кДж / моль, вследствие чего при комнатной температуре заслоненные конформации не возникают, а $69\%$ молекул этого вещества находятся в самой стабильной заторможенной анти-конформации и $31\%$ - в гош-конформации (рис. 2).
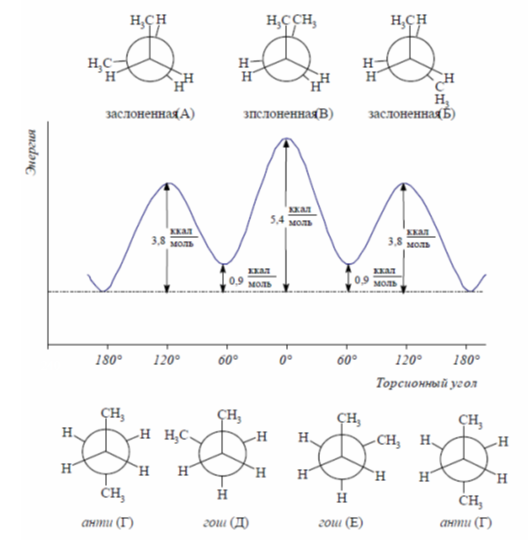
Рисунок 2. Зависимость потенциальной энергии н-бутана от угла $\varphi$
Составы конформационных смесей насыщенных углеводородов
Точные составы конформационных смесей определяются разностями свободных энергий конформаций $\triangle G^\circ$(конф.) с помощью уравнения Гиббса. В табл. 1 указаны расчетные значения энергии взаимодействий различных групп в насыщенных углеводородах.
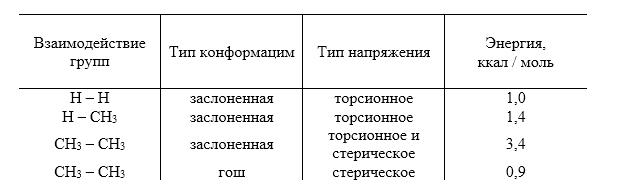
Рисунок 3. Расчетные значения энергии взаимодействий различных групп в насыщенных углеводородах
Характерными особенностями конформаций разветвленных насыщенных углеводородов является обязательное наличие скошенного (гош-бутанового) взаимодействия электронных оболочек метильных или других алкильных заместителей и атомов водорода основных углеродных цепей. Так моно-метилзамещенные алканы в наиболее стабильных конформационных формах имеют одно или два гош-взаимодействия. В 2-метилзамещенных углеводородах наблюдается лишь одно гош-взаимодействие. В 3-метил-, 4-метил- и более замещенных алканов в наиболее стабильных из гош-конформаций наблюдается два гош-взаимодействия метильных групп и атомов водорода основных углеродных цепей.
Энергия конформационых форм
Для оценки энергий конформационых форм разветвленных углеводородов пользуются принципом аддитивности энергий взаимодействий групп $H-H$, $H-CH_3$ и $CH_3-CH_3$, которые приведенны в табл. 1. В качестве примера на рисунке 4 приведены зависимости потенциальных энергий различных конформационных форм 2-метилбутана от торсионного угла поворота вокруг центральной углерод-углеродной связи.
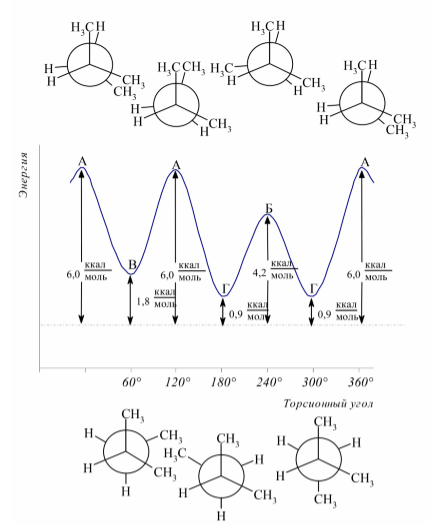
Рисунок 4.
Различия в энергиях между заслоненной конформацией и гош-конформером 2-метилбутана соответствуют принципу аддитивности энергии взаимодействий атомов и групп.
Подобный подход оказывается верным и при оценке стабильности других разветвленных алканов. Так, например, из двух гош-конформацонных форм 2,3-диметилбутана наиболее стабильной оказывается та, где имеются два гош-взаимодействия метильных групп:
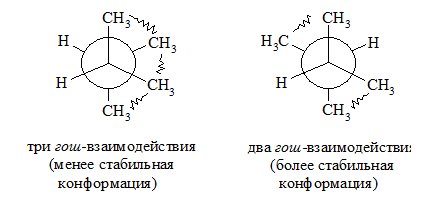
Рисунок 5.












