
Аналогично циклопропану скелетные МО циклобутана строяться из четырех метиленовых систем:
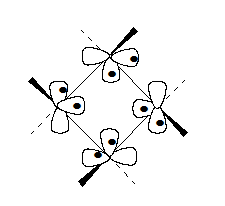
Рисунок 1.
Орбитали циклобутана
Условно молекулы циклобутана можно представить в виде плоской квадратной, а не складчатой, структуры. Используя представление о $n\sigma$ и $n\pi$-орбитали, можно построить МО, показанные на рис. 2.
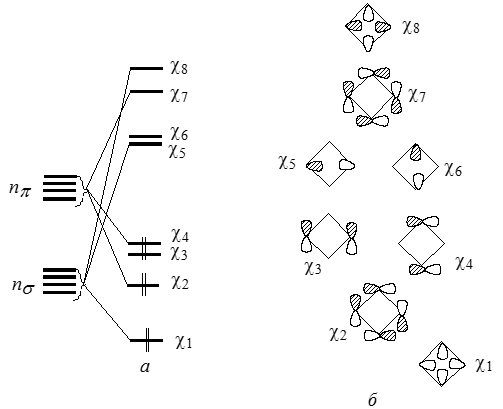
Рисунок 2. Расщепления $n\sigma$- и $n\pi$- МО при образовании циклобутана из четырех метиленовых систем (а) и формы этих орбиталей (б)
У циклобутана имеется пара вырожденных ВЗМО - $\chi3$ и $\chi4$. А также пара вырожденных НСМО - $\chi5$ и $\chi6$. Орбитали $\chi3$ и $\chi4$ слабосвязующие, а орбитали $\chi5$ и $\chi6$ -- слаборазрыхляющие. Из-за того, что в них взаимодействует базисная орбиталь атома углерода, расположенного в противоположных углах четырехчленных циклов ("длинные связи"). Это обуславливает нарушение правила последовательности МО ($\sigma-\pi-\pi*-\sigma*$) и указанные четыре МО расположены между МО $\chi2$ и $\chi7$ вблизи несвязующего уровня.
Некоторым МО, изображенным на рис. 2, можно придать и другую, альтернативную форму. Так, комбинации орбиталей $\frac{\chi3}{\chi6}$ и $\frac{\chi4}{\chi5}$ имеют одинаковые симметрии и поэтому могут смешиваться:
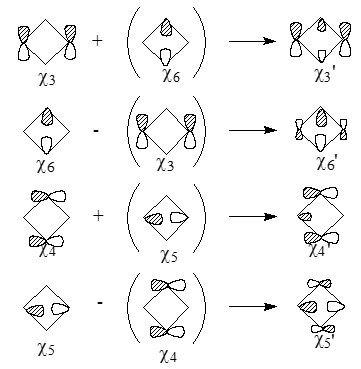
Рисунок 3.
После смешивания пар вырожденных МО $\frac{\chi3'}{\chi4'}$ и $\frac{\chi5'}{\chi6'}$, получаются альтернативные формы - $\chi3"$, $\chi4"$, $\chi5"$ и $\chi6"$, которые представляют собой связующие и антисвязующие комбинации $\sigma $ и $\sigma*$-МО параллельных связей циклобутановых колец:
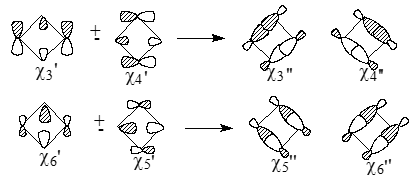
Рисунок 4.
Объяснение свойств соединений, который содержат четырехчленный цикл
Рассмотрим пример, который показывает как изображенные на рис. 2 МО можно использовать для объяснений химических и физических свойств соединений, который содержат четырехчленный циклы. Трициклооктадиен (А) легко перестраиваеться в семибульвален через промежуточные бирадикалы при низких температурах. Однако очень похожие молекулы трициклического тетраена (Б) абсолютно стабильны.
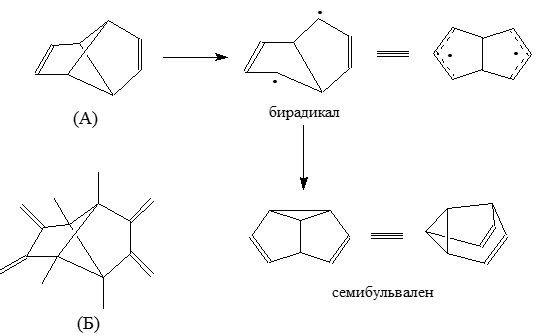
Рисунок 5.
Для обьяснения таких различий, определяют, что соединения А представляют собой циклобутановые кольца с двумя $1,3$-этиленовыми мостиками, а соединения Б - циклобутановые кольца с двумя бутадиеновыми мостиками. Указанные различия между системами можно рассматривать и на более простых структурах В и Г с одним мостиком:
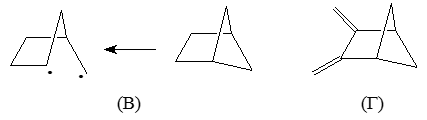
Рисунок 6.
Взаимодействие граничных орбиталей этиленового и циклобутанового фрагментов в соединении В показано на рис. 6.
![Орбитальные взаимодействия в 2,3-бис-метиленбицикло[2.2.1]гексане и формы граничных МО](/assets/files/articles/him277.png)
Рисунок 7. Орбитальные взаимодействия в 2,3-бис-метиленбицикло[2.2.1]гексане и формы граничных МО
Взаимодействия с циклобутановыми кольцами
Можно сделать вывод, что из-за взаимодействий с циклобутановыми кольцами энергетические щели между ВЗМО и НСМО становятся меньше, чем в этилене. $\pi$-МО перекрываются с заполненными орбиталями $\chi3$ (или $\chi4$) циклобутана, и, таким образом, дестабилизируются, тогда как уровни $\pi*$, наоборот, стабилизируются взаимодействиямим с пустыми уровнями $\chi7$.
Совершенно противоположные эффекты наблюдаются в соединениях Г с бутадиеновыми фрагментами. Энергетические щели между ВЗМО и НСМО расширяются (если сравнивать с бутадиеном). В данных случаях бутадиеновые ВЗМО $\pi^2$ подходят по симметрии к $\chi7$-орбиталям циклобутана и, следовательно, стабилизируются, а НСМО бутадиена $\pi^3*$ дестабилизируются (рис. 7).
![Орбитальные взаимодействия и бицикло[2.2.1]гексене-2 и форма граничных орбиталей](/assets/files/articles/him278.png)
Рисунок 8. Орбитальные взаимодействия и бицикло[2.2.1]гексене-2 и форма граничных орбиталей
В соединениях Г щели между ВЗМО и НСМО очень широкие, и вследствие этого исчезают движущие силы для аналогичных эффектов Яна-Теллера. Несмотря на то, что по энергии напряжения цикла соединения В и Г близки, последние термически гораздо более стабильны.











