Первоначальное описание природы кислот и оснований
Еще до работ Оствальда и Аррениуса предпринимались попытки дать определения кислоты и основания. В то время единственной особенностью кислоты было действие на растительные красители (лакмус) и наличие кислого вкуса. Особенностью оснований являлась моющая способность и ощущение «мыльноости».
В XVII веке термины кислоты и основания уже сформировались. Со временем эти понятия все время дополнялись и уточнялись.
Было выяснено, что кислоты взаимодействуют с основаниями с образованием солей. Термин «основание» заменили термином «щелочь», обозначающий соединение, противоположное кислоте.
Существуют разные взгляды на природу кислот и оснований. Изучением их свойств занимались:
-
$1663$ г. Бойль;
-
$1780$ г. Лавуазье разработал «кислородную теорию» кислот. Свойства кислот, согласно теории, объясняются наличием в их молекулах кислорода. Однако, позже выяснилось, что многие кислоты не содержат кислород (например: плавиковая кислота, сероводородная кислота), в то время как вещества, к кислотам не относящиеся, имеют в своем составе атомы кислорода (оксиды, соли и др.).
-
$1802-1819$ гг. И Берцеллиус приписал оксидам электрический заряд. Он считал, что кислоты образуются и электроотрицательных оксидов неметаллов, а основания -- из электроположительных оксидов металлов.
-
$1814$ г. Дэви предположил, что в состав кислот всегда входит водород. Это является обязательным условием образования кислот. Эта идея положила начало созданию «водородной теории» кислот.
-
$1838$ г. Либих. Охарактеризовал кислоты как вещества, имеющие в своем составе водород, способный замещаться металлами. Однако он не смог объяснить как наличие водорода может обуславливать кислотные свойства.
-
$1887$ г. С. Аррениус на основании теории электролитической диссоциации сформулировал ионную теорию кислот и оснований. Кислота -- это вещество, содержащее водород. При диссоциации кислоты в воде образуются положительно заряженные ионы -- катионы водорода и отрицательно заряженные -- анионы. При диссоциации основания образуются отрицательно заряженные ионы гидроксила и катионы водорода.
-
$1924$ г. Э Франклин разработал сольвентную теорию кислот. При растворении кислот и оснований концентрация катионов и анионов увеличивается. Сольвентная теория наиболее актуальна при исследовании кислот и оснований в неводных растворах. Взаимодействие кислот и оснований можно выразить схемой:
$Кислота \ + \ основание \ > \ соль \ + \ растворитель$
-
$1907$ г. А. Вернер сформулировал теорию ангидро -- и аквакислот и оснований. Безводные соединения (ангидро -- кислоты $A$ и ангидро - основания $B$) в водном растворе способны превращаться в аква -- кислоты $[AOH]^-H^+$ и аква -- основания $[BH]^+OH^-$,которые диссоциируют:
$[AOH]^-H^+ > [AOH]^-+H^+$
$[BH]^+OH^- > [BH]^++OH^-$
Исследования Оствальда - Аррениуса
В $1887$ г. Оствальд -- Аррениус определил, что усиление кислотных свойств зависит от присутствия в растворе ионов водорода, основания в растворе дают гидроксид-ионы и способы нейтрализовать кислоты по схеме:
$H^+ + OH^- >H_2O$
Однако его теория не могла объяснить многих явлений.
Почему раствор этилата натрия $C_2H_5ONa$ в растворе обладает основными свойствами, хотя и не содержит гидроксид-ионы $OH^-$, а диссоциирует с образованием аниона $C_2H_5O^-$. Аммиак способен лучше нейтрализовать кислоты, поглощая протон, чем основания, содержащие гидроксид-ионы:
$NH_3 + H^+ > NH_4^+$
Диаметр протона водорода очень мал: $10^{-15}$ м. Электрическое поле вокруг протона настолько велико, что он начинает притягивать к себе молекулы с неподеленной электронной парой (например, молекулы воды $H_2O$).
Спектроскопически выяснили, что реакция взаимодействия катиона водорода с водой сопровождается выделением энергии $1300 кДж \cdot моль^-1$.
$H^+ + H_2O > H_3O^+$
Высокая экзотермичность реакции доказывает, что в растворе не могут существовать негидратированные протоны.
Гидратировнный протон называют ионом оксония $H_3O^+$. Катион оксония может сольватироваться молекулами воды и, тогда его запись приобретает вид: $H_9O_4^+$. В этаноловых растворах он будет присутствовать в виде катиона $C_2H_5OH_2^+$, а в жидком аммиаке как ион $NH_{4}^+.$
Современные представления о природе кислот и оснований
Существует несколько обобщенных теорий кислот и оснований. К важнейшим из них относятся:
-
Протонная теория. Согласно этой теории кислота выступает донором протона. В результате отдачи протона кислота переходит в основание, сопряженное кислоте.
Например:

Рисунок 1.Основание является акцептором протона. В результате присоединения протона оно переходит в кислоту, сопряженную основанию.
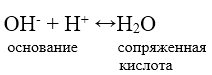
Рисунок 2.Сопряженные кислота и основания являются протолитами, образуют протолитическую систему:
$Кислота \ ↔ \ Основание + H^+$
Протолиты могут быть:
-
нейтральными;
-
молекулярными;
-
катионными;
-
анионными.
Например:
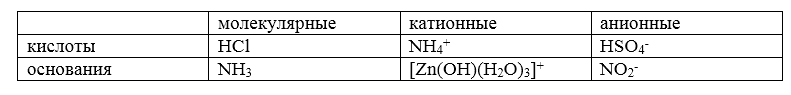
Рисунок 3.Амфолитами называют вещества, кислотно -- основное поведение которых определяется другими участниками реакции. Амфолиты могут выступать как в качестве кислоты так и в качестве основания. Для этих веществ характерно кислотно -- основное диспропорционирование.
Примеры амфолитов:
$Вода \ H_2O + H_2O ↔ H_3O^+ + OH^-$,
$H_2O \ (кислота) ↔ H^+ + OH^-$,
$H_2O \ (основание) + H^+ ↔ H_3O^-$;
Аммиак $NH_3 + NH_3 - NH_4^+ + NH_2^-$;
Плавиковая кислота $HF + HF ↔ H_2F^+ +F^-$
В ряду $NH_3$, $H_2O$, $HF$ наибольшим сродством к протону обладает жидкий аммиак $NH_3$. Поэтому в его среде вода будет выступать как сильная кислота, а в жидком фтористом водороде -- как сильное основание.
$NH_3 + H_2O → NH_4^+ + OH^-$,
$HF + H_2O → F^- + H_3O^+$.
Вещества, которые проявляют в водном растворе свойства слабых кислот ($NCN$, $CH_3COOH$, $H_2S$, $HF$ и др.), в среде $NH_3$ становятся сильными кислотами:
$HCN + NH3 → NH_4^+ + CN^-$.
В среде фтороводорода, который обладает малым сродством к протону, большинство веществ, содержащих водород, будут основаниями:
$HNO_3 + HF ↔ H_2NO_3^+ + F^-$.
Протонная теория может быть применима ко всем сольвосистемам, в которых возможен переход протонов. В реакциях, протекающих при высоких температурах, она не применима.
-
-
Электронная теория. Кислота выступает акцептором электронных пар. Это может быть ион, атом, молекула с незавершенной электронной конфигурацией, которые могут присоединять электронные пары для образования ковалентной связи.
Основание является донором электронных пар. Также участвует в образовании ковалентной связи.
Кислотно -- основное взаимодействие приводит к образованию донорно -- акцепторной связи.
Например:
$HCl + NH_3 > NH_4Cl$,
$Ag^+ + 2NH_3 > [Ag(NH_3)_2]^+$,
$AlCl_3 + Cl^- >[AlCl_4]^-$.
Электронную теорию применяют, если:
- рассматривают процессы, протекающие без растворителя;
- в сольвосистемах, в которых не наблюдается обмен протонов;
- рассматривают реакции, протекающие при высоких температурах.












