Основные определения кислот и оснований
Многие реакции, протекающие без изменения степеней окисления элементов, относят к кислотно -- основным равновесиям. Существует множество их классификаций, в зависимости от того, что понимают под кислотой или основанием. В таблице приведены наиболее распространенные определения кислот и оснований.
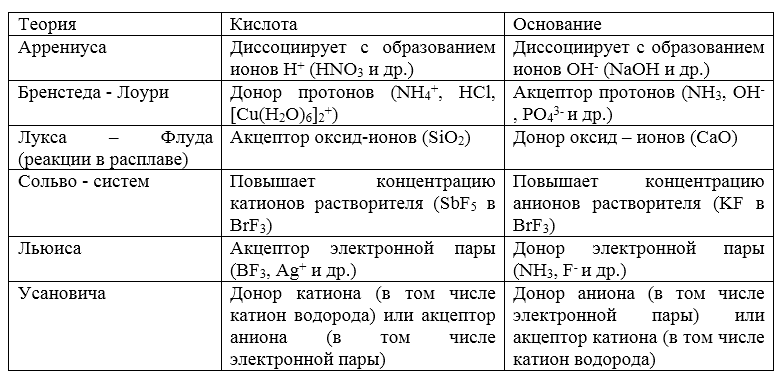
Рисунок 1. Основные определения кислот и оснований
Так как наиболее распространенный растворитель -- вода, в качестве первого приближения чаще всего используется теория Аррениуса. Теория Бренстеда -- Лоури позволяет количественно описать кислотно -- основные равновесия.
Сложные гетеросоединения
Среди всех соединений вода, по своим кислотно -- основным свойствам занимает промежуточное положение. Поэтому характер ее взаимодействий с другими веществами довольно разнообразен.
Так, при взаимодействии воды с оксидами щелочных металлов, образуются растворимые основания -- щелочи. Они представляют собой гидроксиды металлов, которые хорошо растворяются в воде и полностью диссоциируют с образованием ионов.
$Na_2O + H_2O + 151,5$ кДж $ > 2NaOH$
$NaOH + aq - 41,8$ кДж $ > [Na+]aq + [OH^-]aq$
Символ $«aq»$ обозначает большое количество воды, в которой может раствориться $1$ моль $NaOH$ с образованием ионов, гидратированных молекулами воды.
Гидраты, образующиеся в результате взаимодействия оксидов неметаллов с водой, называют кислотами.
$SO_3 + H_2O - 132,2$ кДж $ > H_2SO_4$
Гидроксид при растворении в избытке воды гидратируется дальше, в результате чего диссоциирует на катионы водорода и анионы кислотного остатка:
$H_2SO_4+ aq - 92,5$кДж $ >2H^+ (aq) + SO_4^{2-}(aq)$
Кислотные свойства раствора будет определять концентрация ионов водорода в нем.
Кислота - это вещество, которое в процессе электролитической диссоциации при растворении в воде образует раствор, содержащий избыток ионов водорода.
Основание -- это гидроксид, который в процессе электролитической диссоциации при растворении в воде образует раствор, содержащий избыток ионов гидроксила.
Амфотерность
Гидратация, приводящая к образованию кислот:
$ROH + aq > RO^- (aq) + H^+(aq)$,
характерна в тех случаях, когда связь $H-O$ в гидроксиде более полярна, чем связь $R-O$.
Если у гидоксида связь $R-O$ более полярна, чем связь $H-O$, то в процессе гидратации образуется основание:
$ROH + aq > R+ (aq) + OH^-(aq)$
Гидроксид одновременно будет проявлять свойства и слабой кислоты и слабого основания, если величины полярностей обеих связей в молекуле $ROH$ сравнимы по величине. Это свойство электролитов называется амфотерность, а вещество проявляющее данное свойство -- амфотерное вещество.
Амфотерный гидроксид в щелочной среде ведет себя как кислота:
$ROH + OH^-(aq) > RO^- (aq) + H_2O$,
а в кислой среде ведет себя как основание:
$ROH + H^+(aq) > R^+ + H_2O$.
Гидроксид алюминия $AlCl_3$ является слабоосновным веществом. Он растворяется как в растворах кислот, так и в растворах щелочей:
$Al(OH)^3 + 3H^+(aq) - 106$ кДж $ > Al^{3+}(aq) + 3H_2O$,
$H_3AlO_3 + OH^-(aq) + 19,7$ кДж $ > AlO_{2^-} (aq) + H_2O$
У оксидов одного и того же элемента можно наблюдать изменение кислотных и основных свойств. Так у металлов низшие кислородные формы являются основными, высшие -- кислотными, а промежуточные -- амфотерными.
Оксиды марганца имеют следующие формы:
-
основный оксид $MnO$;
-
амфотерные оксиды $Mn_2O_3$, $MnO_2$;
-
кислотный оксид $MnO_3$, $Mn_2O_7$.
Основный оксид может реагировать с кислотой, а кислотный -- с основанием.
$MnO + 2H^+(aq) - 119,6$ кДж $ > Mn^{2^+}(aq) + 3H_2O$,
$0,5Mn_2O_7 + OH^-(aq) - 67,2$ кДж $ > MnO_{4^- }(aq) + 0,5H_2O$
Если подобное семейство образует неметалл, то прослеживается та же закономерность.
Классификация кислот и оснований по основности и по кислотности
В зависимости от того, сколько атомов водорода в кислоте способно заместиться на металл, кислоты подразделяют на:
-
одноосновные ($HNO_3$);
-
двухосновные ($H_2SO_4$);
-
трехосновные ($H_3PO_4$);
-
четырехосновные ($H_4P_2O_7$).
Если основание содержит более одной гидроксильной группы, оно называется многокислотным. Различают следующие виды оснований:
-
однокислотные ($NaOH$);
-
двухкислотные ($Ca(OH)_2$);
-
трехкислотные ($Al(OH)_3$).













