Критерии определения кислот и оснований Льюиса
В качестве основы своих определений кислот и оснований Льюис выбрал четыре экспериментальных критерия:
-
Нейтрализация. Как быстро и в какой степени кислоты и основания могут соединяться друг с другом.
-
Титрование с индикаторами. Способность кислот и оснований титровать друг друга при помощи индикаторов.
-
Вытеснение. Способность кислот и оснований вытеснять из соединений более слабую кислоту или основание.
-
Катализ. Способность кислот и оснований выступать в качестве катализатора.
Для того чтобы определить, к какому классу, кислот или оснований, относится вещество, необходимо, чтобы оно характеризовалось всеми четырьмя критериями. При этом нейтрализации и титрованию с индикаторами Льюис придавал особое значение. Согласно этому, он дал следующие определения.
Кислоты - вещества, которые, подобно хлористому водороду, нейтрализуют едкий натр или любое другое основание.
Основания - вещества, которые, подобно едкому натру, нейтрализуют хлористый водород или любую другую кислоту.
Вещества, способные реагировать в обоих направлениях, Льюис отнес к амфотерным веществам.
Теория Льюиса
В $1930-1940$ гг. Льюис предложил новое определение кислот и оснований. Его теория базируется на электронном строении вещества, поэтому ее также называют электронной теорией. Льюис считал, что кислотно -- основные реакции являются таким типом взаимодействия, при котором неподеленная электронная пара молекулы основания присоединяется к молекуле кислоты. При этом основание выступает донором, а кислота -- акцептором. В образовавшейся молекуле общая электронная пара принадлежит двум атомам, то есть обобществлена. В результате возникает донорно -- акцепторная ковалентная связь.
В реакции взаимодействия аммиака с трифторидом бора аммиак отдает электронную пару (выступает в роли основания), а трифторид бора принимает (выступает в роли кислоты)
$NH_3 + BF_3 > NH_3BF_3$
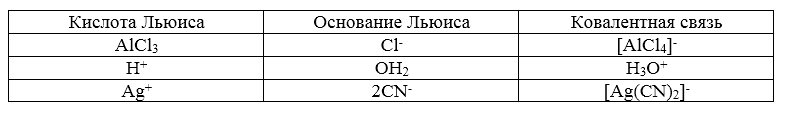
Рисунок 1.
Определение основания Льюиса включает и определение Бренстеда -- Лаури, так как атомы с неподеленной электронной парой присоединяют протон кислоты Бренстеда -- Лаури.
Кислоты Льюиса ($L$-кислоты) и основания могут не содержать протонов, и тогда их называют апротонными.
Кислоты Льюиса как $BF_3$ и $SO_3$ не являются кислотами Бренстеда -- Лаури, а кислоты $HCl$, $H_2SO_4$, $CH_3CO_2H$, не являются кислотами Льюиса.
Вещества, которые являются донорами электронных пар, называют основаниями по Льюису. Вещества - акцепторы электронных пар называют кислотами по Льюису.
Теория Льюиса не позволяет количественно определить силу кислот.
Частицы, имеющие в своем составе атомы с неподеленными электронными парами, называют основаниями Льюиса ($:O$, $:N$, $:Cl$, $:F$, $OH^-$, $NH_3$, $F^-$).
Координационно ненасыщенные частицы, которые имеют в своем составе атомы с вакантными электронными орбиталями, называют кислотами Льюиса ($H^+$, $Al$ в $AlCl_3$, $Sb$ в $SbF_5$, $B$ в $BF_3$).
К основаниям по Льюису относятся следующие соединения:
-
вещества, содержащие аминный азот (алифатические и ароматические амины, аммиак, пиридин и др.);
-
кислородсодержащие соединения вида $R_2CO$, где $R$- органический радикал, атом галогена, ионы галогена.
Кислотами по Льюису являются:
-
галогениды алюминия, бора, кремния, мышьяка, олова, сурьмы, фосфора и др.;
-
ионы -- комплексообразователи ($Ag^+$, $Cr^{3+}$, $CO^{3+}$, $Pt^{2+}$ и др.).
$L$ - кислоты - это большинство катионов, основания Льюиса -- большинство оснований. Соли представляют собой кислотно -- основные комплексы.
Классификация кислот и оснований Льюиса
Р.Дж. Пирсон в $1936$ году предложил классификацию кислот и оснований Льюиса. Согласно этой классификации:
-
Жесткие кислоты характеризуются малым радиусом и высоким положительным зарядом. Они имеют высокую электроотрицательность, низкую поляризуемость, хорошие акцепторы электронных пар.
Например: $H^+$, $Be^{2+}$, $Mn^{2+}$, $Al^{3+}$, $Si^{4+}$, $Fe^{3+}$, $CO^{3+}$ и др.
-
Мягкие кислоты имеют меньший заряд по сравнению с жесткими кислотами, обладают большей поляризуемостью и невысокой электроотрицательностью.
Например: $Cu^+$, $Ag^+$, $Au^+$, $Hg^+$, $Pt^{2+}$ и др.
-
Промежуточные кислоты проявляют средние значения зарядов ядер, электроотрицательности и поляризуемости между жесткими и мягкими кислотами.
Например: $Fe^{2+}$, $CO^{2+}$, $Ni^{2+}$, $Ru^{2+}$, $OS^{2+}$ и др.
-
Жесткие основания имеют высокую электроотрицательность, плохо поляризуются и окисляются.
Например: $F^-$, $Cl^-$, $OH^-$, $NH_3$, $H_2O$ и др.
-
Мягкие основания имеют малую электроотрицательность, легко поляризуются, проявляют свойства сильных восстановителей.
Например: $H^-$, $I^-$, $S^{2-}$, $CO$, $R_2S$ и др.
Понятие кислотно- основного катализа
В зависимости от природы кислоты и основания различают следующие типы кислотно -- основного катализа:
-
Специфический кислотный (основной) катализ. Активация реакции происходит в результате воздействия ионов гидроксония $H_3O^+$ или ионами гидроксила $OH^-$.
Например: по механизму специфического кислотного катализа протекают гидратация ненасыщенных альдегидов, гидролиз эфиров, ацеталей; специфический основный катализ характерен для гидратации альдегидов, альдольной конденсации и др.
-
Общий кислотный (основной) катализ. Катализатором выступает кислота (кроме $H_3O^+$) или основание Бренстеда.
Например: каталитическое превращение углеводородов нефти (каталитический крекинг, алкилирование, изомеризация) протекает по механизму общего кислотного катализа.
-
Электрофильный ( или нуклеофильный) катализ. Происходит под действием кислот или оснований Льюиса.
Часто апротонные кислоты Льюиса ($BF_3$, $AlCl_3$, $SbF_4$, $ZnCl_2$) и протонные кислоты Бренстеда катализируют одни и те же реакции, при этом каталитическая активность апротонных кислот выше, чем протонных. Это обусловлено тем, что в водных растворах апротонные кислоты превращаются в протонные.
В настоящее время наиболее сильной кислотой является $SbF_5$ в $НF$.
Электронная теория Льюиса рассматривает кислоты и основания более углубленно и широко, чем другие теории кислот и оснований.













