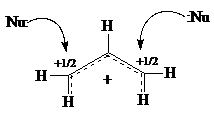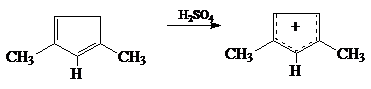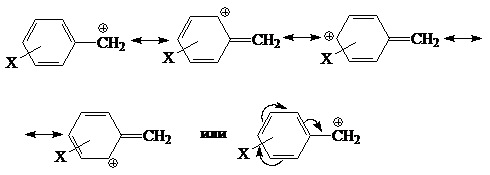Если положительно заряженный атом углерода находится в сопряжении с двойной $C=C$-связью, устойчивость катиона повышается вследствие увеличения делокализации положительного заряда. В аллильном катионе заряд принадлежит двум крайним атомам, поэтому атака нуклеофила равновероятна по обоим крайним положениям:
Рисунок 1.
Устойчивые аллильные катионы получают в концентрированной серной кислоте при растворении в ней 1,3-диенов; например, 1,3-диметил-1,3-циклопентадиен в этих условиях образует катион, полностью симметричная структура которого доказана спектрами ЯМР:
Рисунок 2.
Дивинилметильный катион более устойчив, чем аллильные. Важным примером таких катионов являются аренониевые ионы, играющие роль ключевых интермедиатов в электрофильном ароматическом замещении (см. гл. 13). Тривинилметильные катионы устойчивы лишь при низких температурах во фторсульфоновой кислоте:
Рисунок 3.
Бензильные катионы аналогично аллильным стабилизированы за счет делокализации заряда по цепи сопряжения:
Рисунок 4.
Такие катионы относительно устойчивы в виде солей с $SbF_{6^-}$ в суперкислотах. Еще более устойчивы диарил- и триарилметильные катионы.
Давно известно, что трифенилхлорметан ионизируется до ионных пар и частично до свободных ионов во многих растворителях, не обладающих нуклеофильными свойствами, например в жидком $SO_2$ без добавления $SbF_5$ или $FSO_3H$:
Рисунок 5.
Катионы с ненасыщенными связями как участники реакций галогенирования
Как алкены, так и циклические ненасыщенные соединения реагируют с галогенами с образованием продукта присоединения.
Так реакция присоединения галогена по двойной связи разрушает циклическую $\Pi$-электронную систему бензола. Заметим, что $H°$ для этой реакции примерно равна резонансной энергии бензола.
Бензол и другие арены все же взаимодействуют с хлором или бромом в направлении замещения, но для ускорения взаимодействия надо применить соответствующие кислоты Льюиса, например, железа (III) бромид. Реакция присоединения при этом не наблюдается.
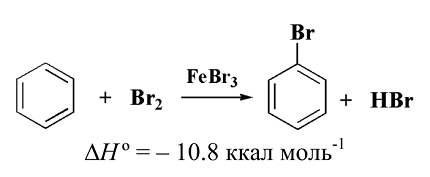
Рисунок 6.
Шестьдесят граммов брома медленно добавляют к смеси 33 г бензола и 2 г железных опилок. Смесь нагревают примерно полчаса, пока не исчезнут красные пары брома. Бромоводород поглощают с помощью $NaOH$ или $Ca(OH)_2$. Добавляют воду, промытый и высушенный органический слой перегоняют и получают 40 г продукта.
Железо быстро реагирует с бромом с образованием бромида железа (III). Безводные галогениды железа (III) являются кислотами Льюиса и энергично взаимодействуют с такими основаниями, как вода
Другие безводные галогениды железа (III) трудно сохранять чистыми, поэтому часто их готовят во время реакции из необходимых элементов, как в предыдущей методике.
Именно характер кислот Льюиса позволяет солям железа (III) быть катализаторами в этой реакции. Часто с этой же целью используют галогениды алюминия. Первой стадией в бромирования алкена является вытеснение нуклеофилом бромид иона как отходящей группы.
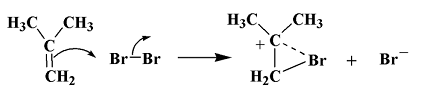
Рисунок 7.
В неполярном растворителе бромид-ион, что уходит, требует дополнительной сольватации бромом.
В этом случае молекула брома служит как мягкая кислота Льюиса, помогает удалить бромид-ион из брома. Этот тип изъятия осуществляется еще энергичнее такими сильными кислотами Льюиса, как бромид железа (III).

Рисунок 8.
Бензол является более слабым нуклеофильным реагентом по сравнению с простым алкеном и требует сильного электрофильного агента для осуществления реакции.
Карбокатионы, образованные в результате галогенирования
Промежуточным соединением при бромировании бензола является коньюгированный карбокатион. Его строение можно изобразить тремя резонансными структурами (структурами Льюиса).

Рисунок 9.
В результирующей структуре почти тетраэдрических атом углерода соединен с плоским пентадиенильним катионом, как это показано на стереоизображение на рис. 1.
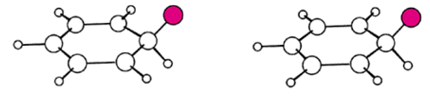
Рисунок 10. Стереоизображение интермедиата при бромировании бензола. Автор24 — интернет-биржа студенческих работ
Этот резонансно стабилизированный пентадиенильний катион часто символически изображается с использованием пунктирной линии, чтобы показать, что положительный заряд делокализованн (рассредоточен) по орто и пара-положениям, обозначенных на предыдущих резонансных структурах зарядами. Однако этот символ не учитывает распределения электронов. Чтобы лучше понять электронные сдвиги, происходящие в реакции, стоит хотя бы на этой стадии использовать структуры Льюиса.
В общем случае карбокатионы могут взаимодействовать с нуклеофильными реагентом, перегруппировываться или терять протон. Промежуточный пентадиенильний катион мог бы прореагировать с нуклеофилом, но тогда бы образовался продукт, не стабилизированный подобно бензольному кольцу. Учитывая это такое направление реакции редко наблюдается при электрофильных ароматических реакциях.