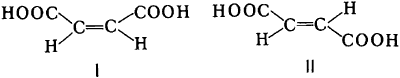Понятие стереохимии соединений углерода
Стереохимия соединений углерода – это раздел органической химии, рассматривающий пространственное строение молекул и его влияние на физико – химические свойства органических соединений.
Виды пространственной изомерии (стереоизомерии):
-
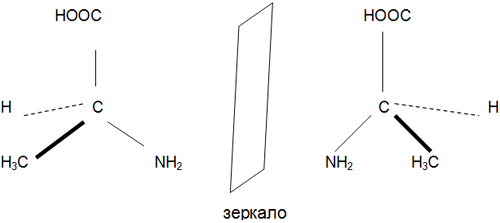
Оптическая изомерия (энантиомерия). Выражается в способности некоторых соединений поворачивать плоскость поляризованного луча в противоположные стороны. Оптическая активность – это способность веществ вращать плоскость поляризации света.
-
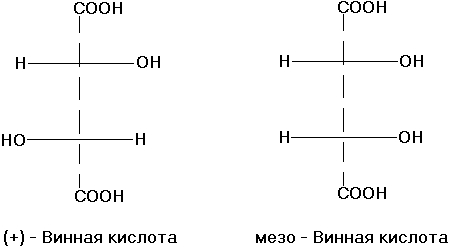
Диастереомерия. Пространственная изомерия, при которой соединения не являются парой оптических антиподов.
- $\sigma$-диастереомерия. Соединения σ-диастереомеры различны конфигурацией части элементов хиральности.
- $\pi$-диастереомерия (геометрическая изомерия). Соединения – геометрические изомеры отличаются разным пространственным расположением заместителей относительно кратной связи.
Хиральность
Хиральность молекул открыл в 1848 году Л.Пастер, изучая рацемический натрий – аммоний тартрат.
В 1874 году Вант-Гоффом и Ж.Ле Белелем была разработана концепция асимметричного атома углерода, после чего стала возможной структурная трактовка хиральности. Само понятие хиральность ввел в конце XIX века Кельвин.
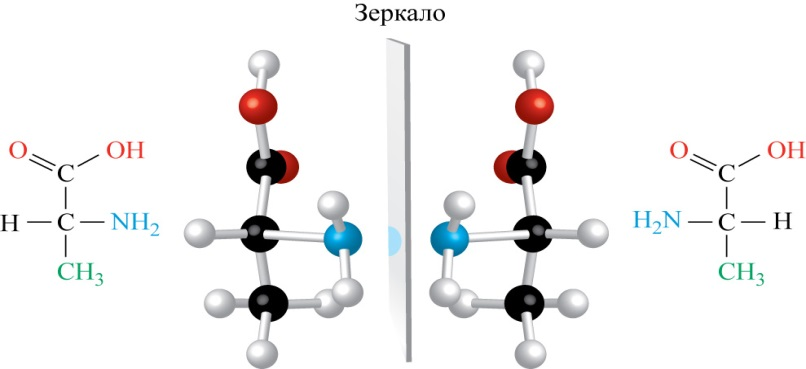
Геометрическая фигура или группа точек называется хиральной, если ее отображение в плоском зеркале не совмещается с нею самою.
Соединения, проявляющие свойства хиральности называют энантиомерами – оптическими изомерами. Каждая молекула с одним хиральным центром может иметь только два энантиомера, то есть каждой молекуле может соответствовать только одно зеркальное отображение.
Если в молекуле есть два хиральных центра, то будет две пары энантиомеров.
Стериохимические модели
В стереохимии необходимым условием является наглядность пространственного строения молекул. Для этого используют стереохимические модели разных типов:
-
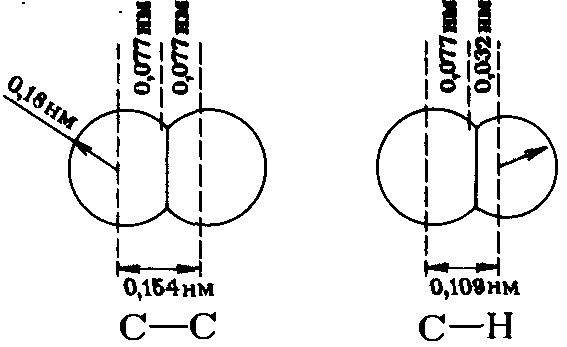
Модели Стюарта – Бриглеба (полусферические модели). Модели атомов имеют вид шаров, их размер в заданном масштабе характеризует ван-дер-ваальсовы радиусы. Атомы углерода и водорода разного диаметра имеют вид:
При образовании химической связи атомы сближаются, что отвечает ван-дер-ваальсовым радиусам. При моделировании часть шара необходимо срезать, при этом расстояние от центра шара до среза должно соответствовать ковалентному радиусу. Складывая атомы – шары получают полусферическую модель, в которой расстояния между центрами шаров передают длину связи как сумму ковалентных радиусов.

-
Модели Дрейдинга и шаро – стержневые модели передают направление и длину связей. Эти модели создают неверное впечатление, что молекула «ажурна» и между атомами много пустого пространства. Необходимо иметь в виду, что «узлы» в моделях Дрейдинга и шары в шаро – стержневых моделях изображают только ядра атомов, но не их полный объем.
Конфигурация и конформация
Под конфигурацией в стереохимии понимают пространственное расположение заместителей относительно стерических центров молекулы (цикла или элемента хиральности, кратной связи).
Способность к различным конфигурациям обусловлена существованием оптических и геометрических изомеров.
Конфигурация не отображает пространственную форму молекулы. При одинаковой конфигурации возможны разные конформации молекулы.
В результате внутреннего вращения атомов или групп атомов вокруг изгиба связей, ординарных связей появляются изменения относительно ориентации отдельных частей молекулы. Это ведет к появлению различных пространственных форм молекулы – ее конформаций.
Каждой конформации присуща своя определенная энергия.
Если молекула может существовать в виде нескольких конформаций, которым отвечает минимум энергии, то такие конформации называют конформационными изомерами (конформерами).
Взаимное превращение конформеров друг в друга называется конформационным переходом.