Нормальные константы заместителей $\sigma^н$
Веркаде, Ван Беккум и Вепстер предложили набор нормальных констант заместителей с обозначением $\sigma н$. По ионизации соответствующих бензойных кислот были определены первичные $\sigma $-константы заместителей: $м-Cl$, $м-F$, $м-I$, $м-CH_3$, $м-NO_2$, $n-NO_2$, $n-COCH_3.$
Предположили, что для перечисленных заместителей можно пренебречь эффектом прямого резонанса. На основании $\sigma $-констант были вычислены значения $\rho $ более чем для $80$ реакций.
Константы $\sigma н$ для других заместителей рассчитали, используя данные, не искаженные влиянием прямого резонанса по уравнению
где $k_{ij}$- константа скорости или равновесия реакции $j$ при наличии заместителя $i$;
$k_{0j}$- предыдущая константа в отсутствии заместителя.
Параметр ${\rho }_j$ является реакционной константой реакции $i$.
$\sigma $-константы могут быть получены из
- констант ионизации замещенных фенилуксусных кислот для всех заместителей;
- для заместителей типа $n-NH_2$ или $n-OCH_3$ - из констант ионизации фенолов;
- для заместителей типа $n-COCH_3$ или $n-CN$ - из констант ионизации фенилборных кислот или удельных скоростей сольволиза бензилхлоридов.
$\sigma $-константы для $+T$ заместителей $(n-OCH_3, n-NH_2)$, которые могут предоставлять электроны по резонансному механизму, применимы только к тем реакциям, в которых нет прямого резонанса заместителей с $T$-реакционным центром (ионизация фенолов).
$\sigma $-константы для $-T$ заместителей $(n-CN, n-NO_2)$, которые могут принимать электроны по резонансному механизму, применимы только к тем реакциям, в которых отсутствует прямой резонанс заместителей с $+T$-реакционным центром.
Использование $\sigma $-констант значительно улучшило точность корреляций.
Например, это можно наблюдать по величинам $\overline{\sigma }$, которые, в соответствии с уравнением Тафта можно найти как
где $\rho $- реакционная константа, найденная при помощи нормальных констант заместителей.
Максимальные и минимальные значения $\overline{\sigma }$, без учета ограничений, для группы $n-CN$ отличаются на $0,64$, а с учетом ограничений - на $0,11$.
Для группы $n-OCH_3$, аналогичные различия равны $0,74$ и $0,04$.
В более чем в $20$ случаях, где для заместителя можно было вычислить больше одной $\overline{\sigma }$-константы, стандартные отклонения варьируют от $0,025$ до $0,14$.
$+T$-заместители: $n-OCH_3, n-OH, n-N(CH_3)_2$ и $n-NH_2$ обнаруживают систематические отклонения, которые невозможно предсказать на основе простой картины прямого резонанса.
Наилучшие значения $\overline{\sigma }$, рассчитанные для заместителей $n-OCH_3, n-OH, n-N(CH_3)_2$ и $n-NH_2$, без учета реакций производных анилина, равны $-0,111; -0,178; -0,172; -0,172$, а с включением таких реакций они составляют $-0,223; -0335; -0,266; -0,423.$
Методика получения констант $\sigma^o$ Тафтом отличалась от методики Ван Беккума, Вепстера и Веркаде. Для $n$-заместителей применялись только реакции ионизации замещенных кислот $C_6H_5CH_2COOH$ и $C_6H_5CH_2CH_2COOH$ и щелочного гидролиза замещенных эфиров $C_6H_5CH_2COOC_2H_5$ и $C_6H_5CH_2OCOH_3$.
Тафт обнаружил, что для некоторых заместителей существует большое различие между константами $\sigma^o$, вычисленных по реакциям в средах с высокой и низкой полярностью.
Положительные и отрицательные значения константы ${\mathbf \sigma }$
Ионизация бензойных кислот протекает легче при наличии электроноакцепторных заместителей и затрудняется в присутствии электронодонорных заместителей.
Так как у сильных кислот величины $pKa$ низкие, то для акцепторных заместителей константы $\sigma >0$, а для донорных заместителей $\sigma
То есть знак $\sigma $ будет противоположен знаку индуктивного и мезомерного эффектов:
- для заместителей с противоположно направленными индуктивным и мезомерным эффектами константа $\sigma $ положительная;
- для заместителей с одинаково направленными положительными индуктивным и мезомерным эффектами константа $\sigma $ имеет отрицательное значение.
Абсолютная величина $\sigma $ указывает на силу заместителя в роли донора или акцептора электронной пары.
Для мета- и пара- соединений величина $\sigma $ зависит от вкладов индуктивного и мезомерного эффектов, вклада электростатического взаимодействия поля. Для орто--положения величина $\sigma $ зависит от объема заместителя и реакционного центра, то есть от пространственных эффектов.
Константа ${\mathbf \rho }$
Если знаки $\sigma $ и $\rho $ будут одинаковыми, то
Положительное значение $\rho $ указывает на то, что протеканию реакции способствуют электроноакцепторные заместители.
Мерой чувствительности реакции к влиянию заместителей является абсолютная величина $\rho $.
Величина $\rho =0,49$ показывает, что реакция для арилуксусных кислот будет менее чувствительна к введению заместителей, чем ионизация бензойных кислот, для которых $\rho =1$; если взять $3$-арлилпропионовые кислоты с показателем $\rho =0,21$, то чувствительность будет еще меньше.
В арилуксусных кислотах заместитель удален от реакционного центра на одну метиленовую группу, в $3$-арлилпропионовых кислотах -- на две группы, что объясняет изменение значения $\rho $.
Влияние заместителей на диссоциацию по мере удаления от реакционного центра будет уменьшаться, пока вообще не перестанет сказываться. При этом $\rho =0.$
Для диссоциации бензойных кислот при переходе от водных растворителей к этанолу, а потом к ДМФА константа $\rho $ увеличивается; она приблизительно одинакова в диполярных апротонных растворителях. Например:
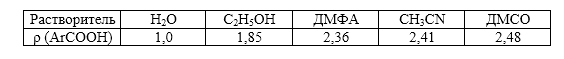
Рисунок 1.
Если брать газовую фазу, то значения $\rho $ будут еще более высокие, что объясняется снижением способности среды сольватировать протон.
Если протеканию реакции способствуют электронодонорные заместители, то $\rho $ принимает отрицательные значения.
При введении заместителей в катион в реакциях катионов арендиазония с аренсульфинатами значения константы $\rho $ будут положительными ($\rho =+3,76$), а при введении заместителей в анион значение $\rho $ станет отрицательным $(\rho =-2,07)$. Акцепторные заместители будут увеличивать силу кислоты $ArN_{2^-}$, но уменьшать силу основания $ArSO_{2^-}.$












