Определение кислот и оснований по Бренстеду и Лаури
В $1923$ г. независимо друг от друга Бренстед и Лаури предложили определение кислот и оснований, учитывающих положение о том, что протон в растворе существовать не может. Согласно их определению,
-
кислота -- это соединение, частицы которого (ионы или молекулы) в результате протонотранспортной реакции способны отдавать протон другому веществу;
-
основание -- это соединение, частицы которого (ионы или молекулы) в результате протонотранспортной реакции принимают протон от другого вещества.
И основание, и кислота во время реакции могут переносить протон, поэтому их называют протолитами. Реакции между протолитами называются протолитическими.
Исходя из этого, кислоты являются протон - донорными веществами, а основания считают протон - акцепторными веществами.
- Кислота ↔ Основание + $H^+$
Однако данное соотношение не описывает истинную реакцию (протон $H^+$ в растворе не существует).
В растворе происходит соперничество за протон, в котором участвует и растворитель. Кислоту и основание, связанные за счет обмена протоном, называют сопряженной кислотно -- основной парой:
-
Кислота $1$ ↔ сопряженное основание $1$+ $H^+$;
-
Основание $2$ + $H^+$ ↔ сопряженная кислота $2$.
В общем виде реакцию между кислотой и основанием можно записать следующим образом:
- Кислота $1$ + Основание $2$ ↔ сопряженное основание $1$ + сопряженная кислота $2$.
Кислота $1$ будет превращаться в сопряженное с ней основание, и, наоборот, основание $2$ превращается в сопряженную с ним кислоту.
Реакции между кислотами и основаниями Бренстеда
Кислотные взаимодействия характеризуются как реакции между кислотами и основаниями. Если в растворе нет основания -- акцептора протона, то вещество как кислота реагировать не может. При этом необходимо присутствие более сильного основания, способного оторвать протон от кислоты. Протон отщепляется от кислоты не самопроизвольно, а под действием основания. Нельзя разделять кислотные и основные свойства, так как существует единое кислотно -- основное взаимодействие.
Вода является амфотерным растворителем и может выступать как в роли кислоты, так и в роли основания.
-
Вода в роли кислоты, является донором протона:
- $RNH_2 + H_2O ↔ RN{H_3}^+ + OH^-$;
- $HS{O_4}^- + H_3O^+ ↔ H_2SO_4 + H_2O$;
- $CH_3{CO}^{2-} + H_2O ↔ CH_3CO_2H + OH^-$.
-
Вода в роли основания, действует как акцептор протонов:
- $HS{O_4}^- + H_2O ↔ H_3O^+ +{SO_4}^{2-}$;
- $CH_3CO_2H + H_2O ↔ H_3O^+ + CH_3CO^{2-}$.
Ионы могут обнаруживать двойные функции: выступать и как основание и как кислота. Свойства конкретного соединения зависят от свойств, проявляемых конкурирующей сопряженной пары.
Гидрокарбонат -- анион $HCO_3$- может проявлять двойственный характер взаимодействия с водой.
-
ведет себя как донор (кислота):
- ${HCO}_{{3^-}(p)} + H_2O(ж) > {H_3O^+}_{(p)} + {{CO_3}^{2-}}_{(p)}$
-
ведет себя как акцептор (основание):
- ${HCO}_{{3^-}(p)} + H_2O(ж) > {H_2CO}_{3 (p)} + {OH^-}_{(p)}$
Вещества - протолиты, способные отдавать и присоединять протоны, называются амфолитами или амфипротонными веществами.
Свойства кислот и оснований противоположны и при взаимодействии они нейтрализуют друг друга, то есть протекает реакция нейтрализации. В результате данной реакции образуется соль (ионное соединение) и вода.
Согласно теории Бренстеда -- Лоури, кислоты можно рассматривать как гидратированные ионы металлов. Вода, которая находится во внутренней сфере ионов, выступает донором протонов.
Протолитическая теория описывает многие равновесия. Примеры таких процессов изображены в таблице:
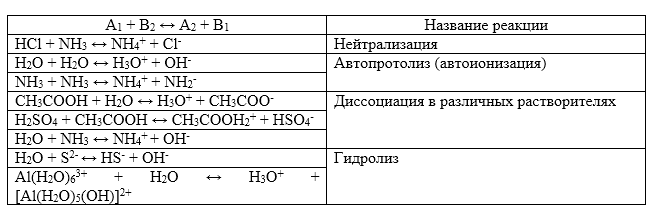
Рисунок 1.
Кислотно - основное титрование - одно из важнейших применений реакции нейтрализации. С его помощью определяют концентрации основания или кислоты в растворе, широко используется в аналитической химии.
При определении концентрации кислоты, пользуются стандартным раствором основания (т.е. с известной концентрацией). И наоборот, при определении концентрации основания пользуются стандартным раствором кислоты.
Количественная характеристика силы кислоты
Кислотно - основные взаимодействия необходимо рассматривать с позиций термодинамики, так как оно является достаточно быстрым и равновесным процессом.
Количественно кислотность вычисляют по отношению к воде. При этом мерой кислотности выступает константа равновесия реакции (константа кислотности) $Ka$:
$A ↔ B + H^+$
Измерить абсолютное значение Кa невозможно, так как данное равновесие возможно при наличии сопряженной пары. Значение константы кислотности можно предопределить относительно выбранного стандарта.
Стандартное равновесие имеет вид:
$H_3O^+ ↔ H_2O + H^+$, $Ka = 1;$
Тогда для любого кислотно -- основного процесса:
$A_1 + B_2 ↔ A_2 + B_1$
Константы кислотности кислоты при взаимодействии с водой будут теми же, что и в теории Аррениуса. Для многоосновных кислот первая константа равновесия всегда больше последующих.











