Химическая реакция происходит тогда, когда разрываются одни связи и образуются другие. Ход той или иной реакции определяется несколькими факторами, главными из которых являются природа реагирующих молекул (реактантов) и атакующих реагентов, температура, концентрация компонентов, катализатор. Важное значение для определения механизма реакции принадлежит природе частиц (промежуточных), которые образуются на промежуточных стадиях расщепления химической связи.
Диссоциация ковалентной связи $C-X$ может происходить по трем основным схемам (рис. 1).
В результате гетеролитических разрыва связи происходит полное смещение пары электронов к тому или иному атома с образованием соответствующих ионов углерода - карбанионы или карбокатионы. При гемолитическом разрыве связи образуются свободные радикалы.
Природа, образование и стабильность промежуточных частиц
Органические ионы и радикалы являются основными интермедиатами большинства реакций и проявляют значительную реакционную способность и выступают в роли реагентов.
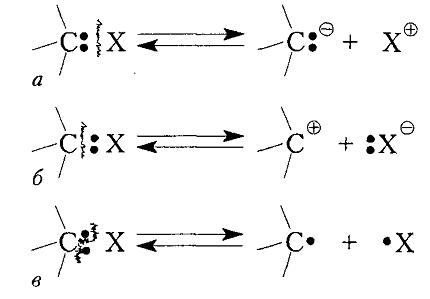
Рисунок 1. Диссоциация связи $C-X$ с образованием: а - карбаниона, б - карбокатиона и в - радикала; а и б - гетеролитическое (ионное), в - гемолитическое (радикальное) расщепление
Карбокатионы
Карбокатионы имеют положительный полный заряд ($+I$) на атоме углерода, который находится в гибридизированному состоянии. Поэтому структура карбокатиона плоская и три гибридные орбитали расположены в одной плоскости под углами $120^\circ$. Вакантная $p-AO$ расположена перпендикулярно к этой плоскости.
Образование карбокатионов. Существует несколько методов образования карбокатионов. Основные из них:
- Присоединение протона к определенным соединениям, среди которых в первую очередь следует назвать ненасыщенные углеводороды и спирты.
- Непосредственная ионизация полярной связи $C-X$ под действием внешней среды. Такой диссоциации связи кроме собственной полярности способствует наличие полярного растворителя или катализатора, например кислот Льюиса
- При каталитической изомеризации алканов и при воздействии на алканы суперкислот вроде комплекса фторсульфоновая кислота - пентафтороантимонат.
Стабильность карбокатионов
Известно, что энергия гетеролитического расщепления связи $C-X$ с образованием карбокатиона (рис. 1, б) достаточно высока и в газовой фазе составляет, например, для алканов, 900-1300 кДж / моль. В результате карбокатионы малоустойчивы, имеют значительную реакционную способность. Стабильность карбокатиона тем выше, чем больше делокализован положительный заряд. Алкильные заместители стабилизируют карбокатион своими донорными свойствами, способствуют уменьшению электронного дефицита на атоме углерода с положительным зарядом. Заместители с отрицательным $I^-$ эффектом дестабилизируют карбокатион, и он становится менее устойчивым.
Однако индукционные и гиперконьюгационные эффекты заместителей проявляют относительно слабые стабилизирующие факторы карбокатионов, к тому же этот эффект в значительной степени утихает при удалении заместителя от свободной $p-AO$. Наибольшее влияние на стабильность карбокатионов производит мезомерный эффект ненасыщенных связей благодаря сопряжению свободной $p-AO$ с $\pi $-связями, расположеного в $\alpha $-положении к этой орбитали
Стабилизация карбокатионов может осуществляться также путем сопряжения вакантной $p-AO$ карбокатионного центра с неразделенной парой электронов гетероатома ($p-p$-сопряжения):
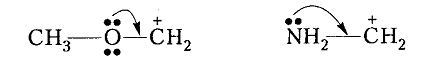
Рисунок 2. Стабильность алкильных радикалов
В значительной степени на стабильность карбокатионов влияет растворитель. В полярных средах катион может существовать в свободном состоянии в результате его сольватационного взаимодействия с молекулами растворителя. В неполярных средах он может существовать в виде ионной пары с противоионом. В отдельных случаях карбокатионы могут быть настолько стабильными, что существуют в виде обычных солей. Например, трифенилметил катион при нормальных условиях представляет собой соль.
Карбанионы
При размещении неразделенной пары электронов на атоме углерода возникают интермедиаты, которые называются карбанионы. Они имеют плоское или пирамидальное строение, и неразделенная пара электронов находится на атомной или на гибридизированной орбитали. Так, для насыщенных соединений характерна пирамидальная или тетраэдрическая конфигурация, подобная конфигурации соединений трехвалентного азота. Неразделенная пара электронов в метил-анионе занимает sp3-гибридную орбиталь. Считают, что для пирамидальной конфигурации карбанионов характерна быстрая инверсия тетраэдра подобно эффекту "вывернутого зонта" в соединениях $NR_3$.
Плоское строение характерно при расположении в $\alpha $-положении к анионного центра $\pi $-связи, например для алил- аниона.
При расположении анионного центра непосредственно у атома углерода с ненасыщенной связью неразделенная электронная пара размещается на соответствующей гибридизированной орбитали ($sp2-$ или $sp-$) и не меняет её состояния гибридизации, например в случае винил аниона и этинил-аниона.
Получение карбанионов
Один из известных методов образования карбанионы это взаимодействие металлов с алкилгалогенидами, например:

Рисунок 3. Стабильность алкильных радикалов
Связь $C-Li$ высокополярных (степень ионности достигает примерно $43\%$), и соединение считается существующей в виде ионной пары метил-аниона и катиона лития ($CH_3\cdot Li+$). Не следует забывать, что такая запись некоторой степени условно, поскольку $57\%$ связи $C-Li$ принадлежит ковалентной составляющей.
Другим методом карбанионы получают при взаимодействии соединений с сильнополярнымы связями ($C-H$-кислоты) и реагентов с основными свойствами:

Рисунок 4. Стабильность алкильных радикалов
Стабильность карбанионов
Стабильность карбанионов зависит от делокализации отрицательного заряда, и может меняться при размещении в $\alpha $-положении к анионному центру электроноакцепторних заместителей с негативным эффектом или заместителей с $\pi $-связями, которые проявляют негативный М-эффект. Проявление мезомерного эффекта заключается в сопряжении молекулярной орбитали $\pi $-связи с несвязующей орбиталью неразделенной пары электронов атома углерода ($p-\pi$ -сопряжения). Стабилизацию ацетонил-аниона можно представить и с помощью резонансных структур:
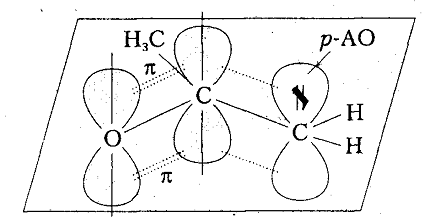
Рисунок 5. Стабильность алкильных радикалов
При размещении в ненасыщенном фрагменте гетероатома (кислорода) с большей электроотрицательностью, чем у углерода, значительная часть отрицательного заряда аккумулируется на гетероатом.
Еще более возрастает стабильность карбанионы под влиянием ароматической системы, например для циклопентадиенильного аниона:
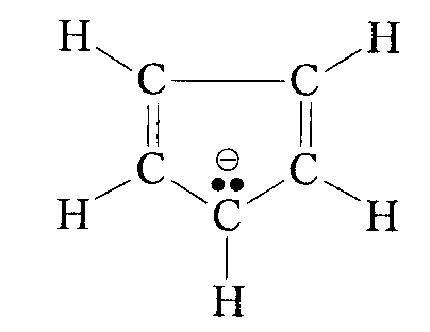
Рисунок 6. Стабильность алкильных радикалов
Кроме того, стабильность карбанионов зависит от природы гибридизации атома углерода. Чем больше вклад $x-AO$ в гибридное состояние, тем устойчивее карбанионы, то есть происходит повышение их стабильности в ряду $sp3
Влияние структурных факторов на стабильность анионов имеет обратное направление по сравнению с катионами. В частности, стабильность карбанионов уменьшается следующим образом: первичный > вторичный > третичный.
Стабильность карбанионы возрастает при расположении в $\alpha $-положении к анионному центру электроноакцепторних групп.
Активно влияет на устойчивость карбанионов также органический растворитель благодаря процессам сольватации.












