Механизм возмущения молекулярных орбиталей
Новые химические связи появляются в результате взаимодействия между несвязанными атомами молекул. При этом старые химические связи могут либо сохраняться (взаимодействие триметилбора с триметиламином), либо разрываться с образованием новых связей (димеризация циклопентадиена).
Согласно теории ВМО (возмущения молекулярных орбиталей), реакция анализируется в самый начальный момент своего развития. Теория возмущения молекулярных орбиталей отвечает на вопрос, повышаться или понижаться энергия системы, если две молекулы или два фрагмента внутри одной молекулы начнут сближаться намного теснее, чем это предопределено ван-дер-ваальсовыми радиусами.
При повышении энергии молекулы расходятся, напротив, при ее понижении молекулы сближаются и происходит реакция. Способность молекул принимать участие в реакции предопределена их структурными свойствами.
Метод возмущения молекулярных орбиталей анализирует сочетание определенных молекулярных свойств, присущих партнерам по реакции, то есть зависимость путей реакции от свойств реагентов.
В самом начале взаимодействия между молекулами реагент ощущает малые возмущения со стороны другого реагента. Малым возмущениям соответствуют небольшие изменения энергии, которые можно представить как расщепление первичных уровней энергии.
Считают, что при перекрывании орбиталей, вступающих в реакцию молекул, превоначально невозмущенные или базисные орбитали возмущают друг друга. В результате формируются новые возмущенные орбитали, одна из которых имеет более высокую, а другая -- более низкую энергию.
Возмущенные орбитали не являются орбиталями конечного продукта реакции, они соответствуют слабому комплексу между двумя молекулами, который образуется на ранней стадии реакции и который можно рассматривать как пару сближенных друг с другом молекул. Этот комплекс также называют супермолекулой.
В супермолекуле каждый из партнеров, входящих в состав комплекса, практически полностью сохраняет свойства изолированной молекулы.
Димеризацию циклопентадиена, можно рассматривать как взаимодействие $\pi $-орбиталей бутадиенового типа одной молекулы с $\pi $-орбиталями двойной связи другой молекулы. В начальном комплексе взаимодействующие молекулярные орбитали являются орбиталями $\pi $-типа, но на более глубокой ступени реакции переходят в $\sigma $-орбитали продукта. Плоская геометрия циклопентадиеновых циклов в первоначальном комплексе практически еще не изменена:
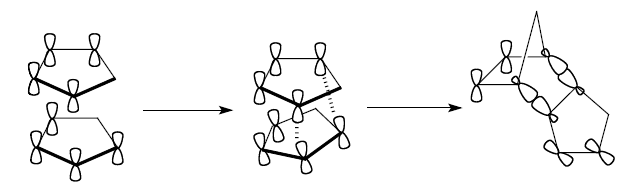
Рисунок 1.
Реакция димеризации циклопентадиена ведет к появлению дополнительного цикла в молекуле продукта:
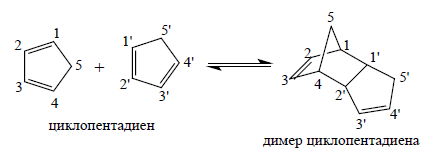
Рисунок 2.
Эта реакция является двусторонней, так как в ней параллельно идут два процесса.
В реакции триметилбора с триметиламиномнаблюдается одностороннее взаимодействие несвязывающей (разрыхляющей) молекулярной орбитали триметиламина, которая содержит неподеленную электронную пару, и пустой молекулярной орбиталью триметилбора:
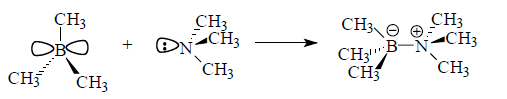
Рисунок 3.
Несвязывающая молекулярная орбиталь триметиламина практически полностью локализована на атоме азота, а пустая орбиталь триметилбора полностью принадлежит атому бора. В данном случае взаимодействие происходит с участием гибридной $sp3$-орбитали (триметиламин) и негибридизованной орбитали (триметилбор).
Варианты образования связывающей и несвязывающей молекулярных орбиталей
Образование молекул из атомов можно представить как возмущение орбиталей. При образовании связывающей и несвязывающей молекулярных орбиталей при взаимодействии двух атомных орбиталей, возможны два варианта:
-
Обе атомные орбитали, вступающие во взаимодействие, обладают близкими энергетическими уровнями. Возникает симметричная молекулярная орбиталь, например
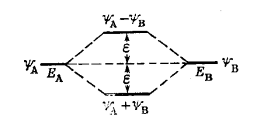
Рисунок 4.Энергетические уровни $EA$ и $EB$ атомных орбиталей $\psi A$ и $\psi B$ равны. Разница между энергетическими уровнями исходных атомных орбиталей и конечной молекулярной орбиталью $(\varepsilon)$ предопределяется резонансным интегралом $\beta $ и называется возмущением первого прядка. Энергетический уровень молекулярной орбитали достигает своего максимального значения, когда атомные орбитали вырождены.
-
Энергетические уровни взаимодействующих атомных орбиталей ($\psi A$ и $\psi B$) сильно друг от друга отличаются. Возникает несимметричная молекулярная орбиталь:
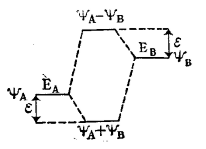
Рисунок 5.В этой молекулярной орбитали связывающая орбиталь $\psi A + \psi B$ близка по энергетическому уровню к исходной атомной орбитали $\psi A$, которая имеет более низкую энергию, а разрыхляющая орбиталь $\psi A - \psi B$ близка позначению энергии к атомной орбитали $\psi B$, имеющей более высокую энергию. Разница между энергетическими уровнями исходных атомных орбиталей и конечной молекулярной орбиталью называется возмущением второго порядка
\[\varepsilon=\frac{{\beta }^2}{\triangle E},\]где $\triangle E$ разница в энергиях между атомными орбиталями $\psi A$ и $\psi B$.
С возрастанием $\triangle E$ значение энергетического уровня молекулярной орбитали уменьшается.
Правила смешения двух орбиталей разной энергии
Существует область малых $\triangle E$, в пределах которой не действуют простые выражения возмущения первого или второго порядков.
Для смешения двух орбиталей разной энергии сформулированы общие правила:
-
при взаимодействии двух орбиталей образуются орбитали -- низшая связывающая ($\psi A + \psi B$) и высшая разрыхляющая $(\psi A - \psi B);$
-
дестабилизация $\psi A$ всегда больше, чем стабилизация $\psi B$;
-
сильное взаимодействие возможно только между орбиталями с близкими энергетическими уровнями наблюдается;
-
если орбитали обладают различной симметрией, то взаимодействие между ними исключено;
-
взаимодействие орбитали $A$ с несколькими другими орбиталями $B, C, D$ и т.д. проходит аддитивно и конечный энергетический уровень орбитали А не зависит от порядка взаимодействия. Если одна из орбиталей $B, C, D$ обладает такой же энергией, как орбиталь $A$, и по симметрии смешивается с орбиталью $A$, то такое взаимодействие учитывается в первую очередь.












