Молекулярные орбитали ацетилена строятся из фрагментов $CH$, которые имеют пять орбиталей:

Рисунок 1.
Диаграмма образования орбиталей ацетилена из молекулярных орбиталей фрагментов $CH$ приведена на рис. 2.
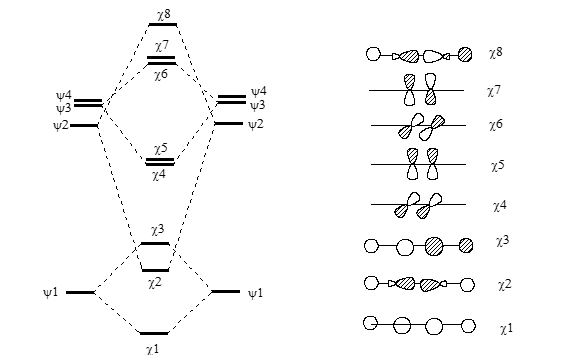
Рисунок 2. Образование МО ацетилена из фрагментов СН: Н2С + СН2 Н2С=СН2
Синглетный метилен $:CH_2$ имеет пустые и дважды занятые молекулярные орбитали. Поскольку электронная пара стремится занять орбиталь с более высоким $s$-характером, занятой будет орбиталь $\psi_3$, а пустой - орбиталь $\psi_4$. При объединении двух молекул $:CH_2$ происходит взаимодействие $\psi_3-\psi_3$ и $\psi_4-\psi_4$:
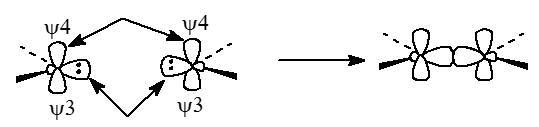
Рисунок 3.
Однако это означает, что между собой взаимодействуют две занятые орбитали - $\psi_3$ и $\psi_3$, что должно приводить к отталкиванию и препятствовать реакции. Предпочтительным является путь, при котором высшие занятые молекулярные орбитали ($\psi_3$) одной частицы $:CH_2$ взаимодействует с низшими занятыми молекулярными орбиталями ($\psi_4$) другой частицы:
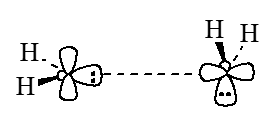
Рисунок 4.
В процессе димеризации группы $CH_2$ постепенно отклоняются из перпендикулярных плоскостей, переходя в одну общую плоскость:
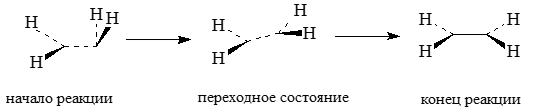
Рисунок 5.
Электронная конфигурация ацетилена
Тройная связь углерод-углерод имеет две области, в которых сосредоточена плотность заряда: ниже и выше плоскости молекулы. Эти два облака заряда относятся к одной и той же орбитали и не могут рассматриваться независимо. Таким образом, плоскость молекулы является узловой плоскостью $\pi $-орбитали.
При описании молекулы ацетилена методом валентных связей (рис. 6) в качестве базиса для описания скелета $H-C-C-H$ используются две гибридные $sp$-орбитали (рис. 6а). Остаются две $2p$-орбитали ($2p_у$ и $2p_z$), не участвующие, в гибридизации. Их перекрывание с такими же орбиталями соседнего атома углерода приводит к образованию двух $\pi $-связей между атомами углерода, причем общее распределение заряда (для четырех электронов) имеет цилиндрическую симметрию относительно оси $C-C$ (см. рис. 6в).
$\pi $-Связи молекул этилена и ацетилена, о которых мы только что говорили, локализованы между двумя атомами углерода. Однако существует много молекул, в которых $\pi $-связи могут быть делокализованы и охватывать более двух ядер. Это как раз те молекулы, которые так трудно изобразить на бумаге с помощью принятых структурных формул, например бензол. Чтобы выразить равноценность всех связей в нем, приходится рисовать по меньшей мере две структурные формулы.
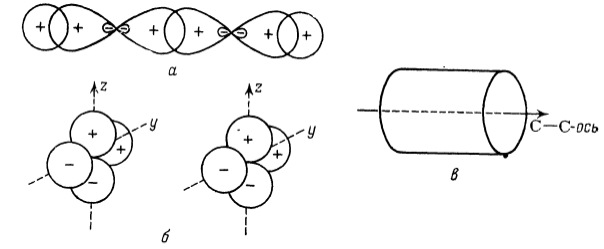
Рисунок 6. Молекулярные орбитали ацетилена
Связывающие молекулярные орбитали ацетилена
Связывающие молекулярные орбитали ацетилена приведены на рис. 7. Высшие занятые молекулярные орбитали образуют вырожденную пару. Отметим, что энергия этих орбиталей ниже, чем энергия МО этена, и поэтому они менее склонны вступать в реакции.
Замена одного из атомов водорода на метальную группу немного повышает энергию вырожденной пары молекулярных орбиталей (энергия становится менее отрицательной) из-за взаимодействия метальных водородов с $\pi $-орбиталями.
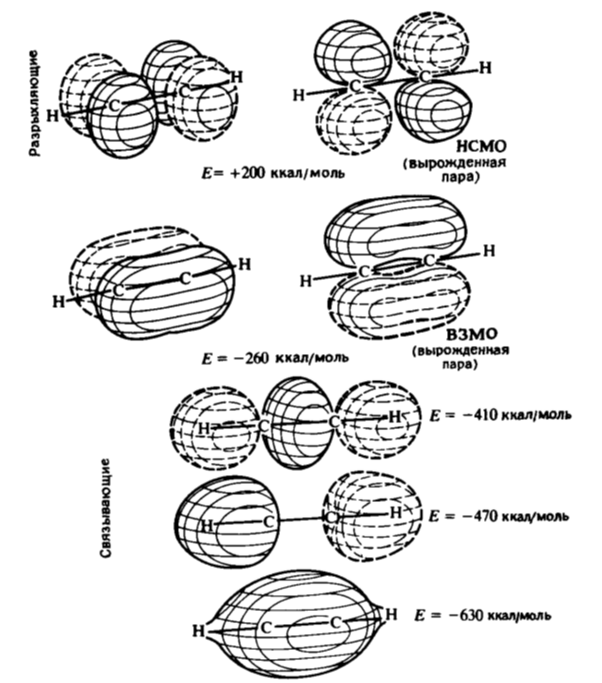
Рисунок 7.












