Основные представления об энантиомерии
Оптически активные соединения встречаются среди органических веществ всех классов: алифатических, алициклических, гетероциклических, ароматических.
Энантиомерия (оптическая активность) проявляется в существовании пар оптических антиподов. Оптическую активность всегда связывали с ассиметрией молекулы. Однако существуют вещества, в которых асимметрии нет – оптически активные вещества.
При сравнении молочной и винной кислот видно, что в молочной кислоте есть асимметричный атом углерода и ее молекула лишена элементов симметрии, она асимметрична. В молекуле винной кислоты элементом симметрии является ось второго порядка, которая проходит в центре молекулы. В таком случае винная кислота уже не асимметричная, а хиральная.
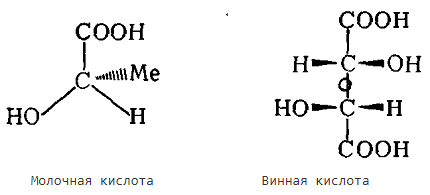
Оптическая активность проявляется в результате либо асимметрии, либо хиральности.
Одним из первых связь оптической активности с присутствием асимметричного атома углерода доказал Э.Фишер. Он показал, что активный моноамид замещенной малоновой кислоты будет терять свою активность при превращении в свободную кислоту:

Доказано, что если вещество обладает единственным асимметричным углеродным атомом, то оно также будет обладать оптической активностью.
Например: иодхлорметансульфокислота и (+)-бромфторхлорметан
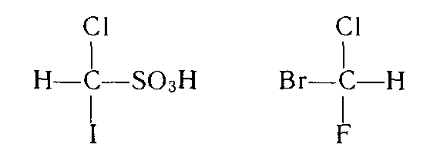
Для возникновения значительного вращения необходимо, чтобы заместители у асимметричного центра были изомерными:
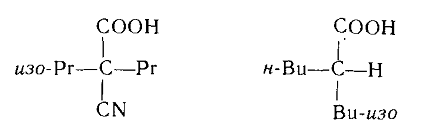
Показано, что для возникновения оптической активности достаточно:
-
цис-, транс-изомерии двух заместителей, находящихся у асимметричного атома:

-
наличие изотопного различия заместителей, находящихся у асимметричного центра.

Типы элементов хиральности
-
Хиральный центр. Хиральный центр может быть образован, например, ассиметричным атомом углерода в молочной кислоте, атомом кремния, фосфора, серы в соединениях метил-α-нафтилфенилсилане (а), о-анизилметилфенилфосфине (б), метил-n-толилсульфоксиде (в).
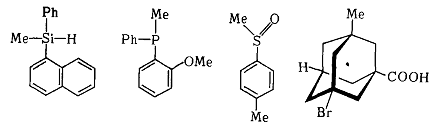
В соединениях (б) и (в) заместители вокруг хирального центра располагаются пирамидально. Все эти структуры можно свести к тетраэдрическому строению, если считать свободную электронную пару четвертым заместителем.
В энантиомерах ряда адаманта (г) хиральный центр размещен внутри молекулы, где атом вовсе отсутствует.
Большинство соединений азота в результате инверсии свободной электронной пары не являются хиральными.
-
Оси хиральности. Наблюдаются в алленах, производных бифенила.
Например: 1,3-дифенилалланин

6,6' - динитробифенилдикарбоновая - 2,2' кислота является примером атропоизомерии – пространственной изомерии, при которой отсутствует свободное вращение вокруг простой связи:
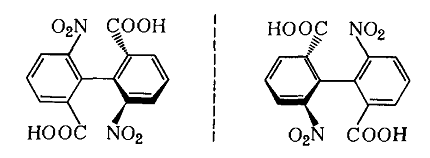
-
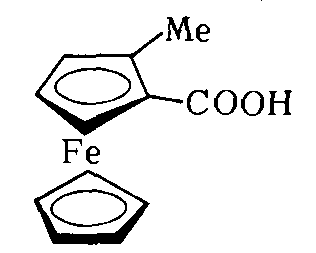
Плоскость хиральности. Присутствует в металлоценах и соответственно замещенных производных ферроцена.
Например: 2-метилферроценкарбоновая кислота
-
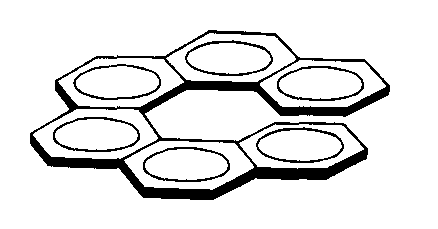
Спиральность. Характерна для соединений, в которых бензольные ядра могут размещаться в одной плоскости. При наличии шести и более ядер, их размещение в одной плоскости становится невозможным и тогда образуется правая или левая спираль. Спиральность присутствует в нуклеиновых кислотах, белках и др. соединениях.
Например: Гексагелицин, построенный из орто-конденсированных бензольных ядер
Свойства оптических изомеров
Оптические антиподы имеют одинаковое строение. Они состоят из одинаковых атомов или групп атомов, одинаково связанных между собой.
Их химические реакции с неактивными реактивами будут тождественны. С оптически активными реактивами антиподы могут реагировать с различными скоростями.
Оптические антиподы обладают одинаковыми физическими свойствами:
- температура кипения и плавления;
- удельный вес;
- показатели преломления и др.
Оптические антиподы будут отличаться только оптическими свойствами: при прочих равных условиях вращают плоскость поляризации света на одинаковое число градусов, один – вправо, другой – влево.
Кристаллы оптических антиподов могут обладать гемиэдрическими сторонами (натрийаммониевая соль винной кислоты).
Рацемические смеси обладают физическими свойствами, сильно отличающимися от свойств соответствующих оптических антиподов.