Циклоприсоединение (реакция Дильса-Альдера)
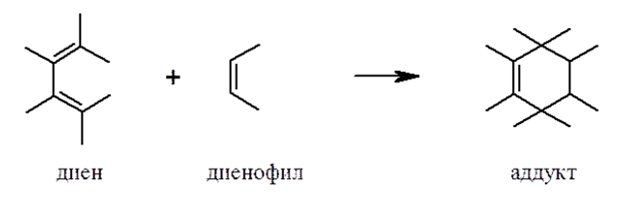
В 1928 г. О. Дильс и К. Альдер открыли реакцию диенового синтеза, в ходе которой взаимодействие сопряженного диена другим непредельным углеводородом (диенофилом) приводит к образованию шестичленного циклического алкена (аддукта). За это открытие оба исследователя были удостоены Нобелевской премии по химии в 1950 г.
Рисунок 1.
Рисунок 2.
При этом реагенты, не имеющие заместителей, взаимодействуют в очень жестких условиях, например, для взаимодействия бутадиена-1,3 с этиленом требуется температура свыше 200°С и давление более 400 атм. Выход реакции при этом невелик. В случае, когда реагенты несут электронодонорные и электроноакцепторные заместители, данная реакция возможна уже при комнатной температуре или при незначительном нагревании с количественным выходом.
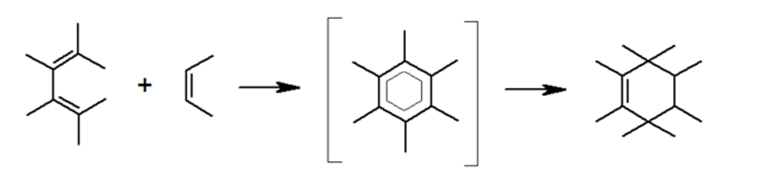
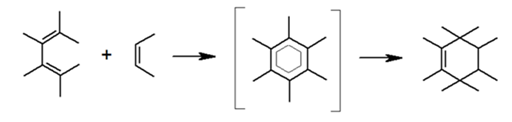
Согласно современной классификации данная реакция относится к классу [4+2]-циклоприсоединения. В ходе процесса происходит разрыв трех $\pi$-связей и образование двух $σ-$ и одной $\pi$-связи. При этом процесс является одностадийным и характеризуется единственным переходным состоянием:
Рисунок 3.
В реакцию Дальса-Альдера помимо бутадиена-1,3 могут вступать циклические, гетероциклические диены, а также енины:
Рисунок 4.
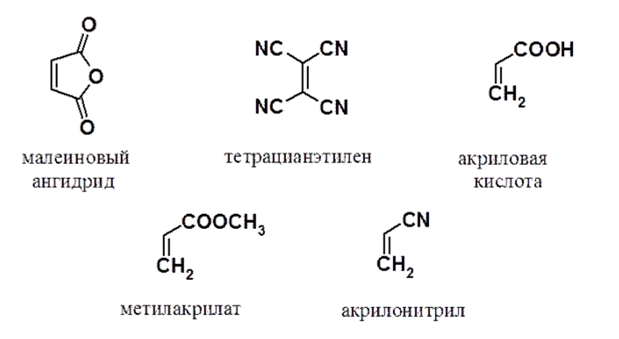
В качестве диенофилов чаще всего используются следующие:
Рисунок 5.
Стереохимия реакции Дильса-Альдера
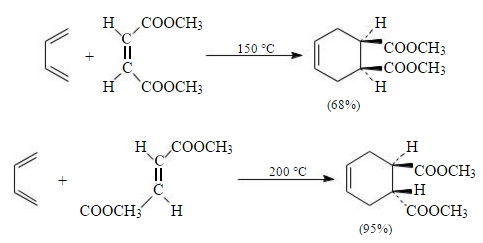
Реакция дильса-Альдера стереоспецифична. Это означает, что пространственные конфигурации реагентов сохраняются в ходе реакции.
Рисунок 6.
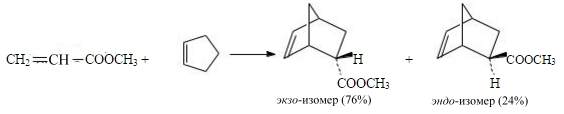
В ходе изучения особенностей протекания реакции Дильса-Альдера с участием различных реагентов было сформулировано еще одно важное стереохимическое правило (правило Альдера): в процессах, контролирующихся кинетически, преимущественно образуется изомер с эндо-положением заместителя X в диенофиле. Т.е., в бициклической системе заместитель X и метиленовый мостик окажутся в транс-положении:
Рисунок 7.
Область применения реакции
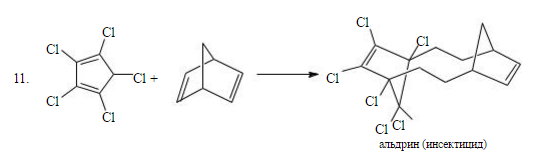
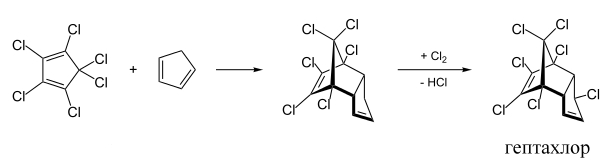
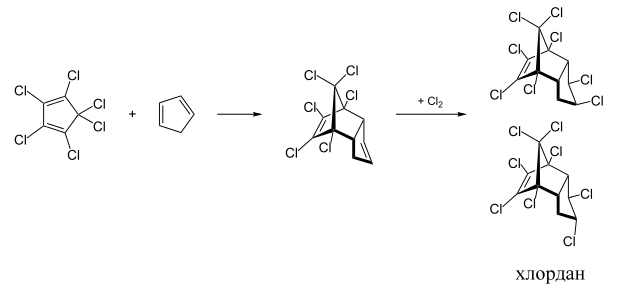
Высокая стерео- и региоселективность реакции Дильса-Альдера, а также широкий спектр возможных реагентов и, соответственно, продуктов, делает эту реакцию незаменимой при синтезе самых разнообразных соединений, например, пестицидов циклодиенового ряда:
Рисунок 8.
Рисунок 9.
Рисунок 10.
Кроме того, реакции Дильса-Альдера протекают в ходе вторичного метаболизма живых организмов. В первую очередь это относится к процессам биосинтеза поликетидов (феромоны насекомых), изопреноидов (витамины, феромоны, гормоны), фенилпропаноидов (структурные компоненты клеточных стенок), алкалоидов (участвуют в формировании защитных функций растений от внешних воздействий, нейромедиаторы у животных).
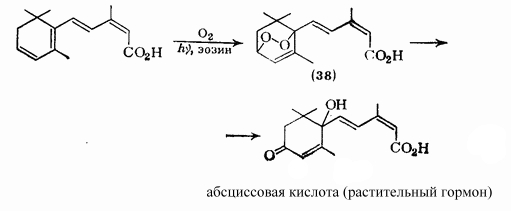
Известен также и внутримолекулярный вариант реакции Дильса-Альдера. Например синтез растительного гормона абсциссовой кислоты:
Рисунок 11.