Дегидрогалогенирование
Дегидрогалогенирование цис-винилгалогенида
Дегидрогалогенирование цис-винилгалогенида происходит под действием сильного основания или алкоголят-иона при температуре 80ºС.

Рисунок 1.Выход аллена составляет 85%.
Например: при элиминировании цис-4-Бромоктена-4 образуется 85% октадиена-3,4. Будет реализоваться только анти-элиминирование, так как соотношение процессов син- и анти-элиминирования сотавляет 1:1500.
Следовательно, в результате анти-элиминирования из транс-4-бромоктена получается один алкин – октин-4.
Дегидрогалогенирование $Z$- и $E$-изомеров
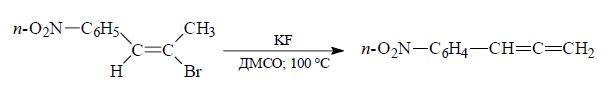
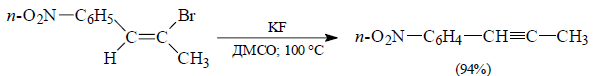
При дегидрогалогенировании двух изомеров ($Z$ и $E$) 2-бром-1-п-нитрофенилпропена под действием KF в ДМСО будет образовываться в одном случае – аллен, в другом – алкин:
Рисунок 2.$Z$-изомер
Рисунок 3.$E$-изомер.
Синтез тетраарилалленов
Путем дегидрогалогенирования можно синтезировать тетраарилаллены. Реакция может протекать двумя путями:

Рисунок 4.
Исходное вещество 1,1,3,3-тетраарилпропены получают в результате взаимодействия диарилгалогенметана с 1,1-диарилэтиленом:

Рисунок 5.
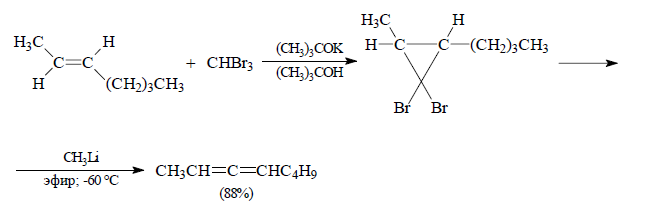
Дегидробромирование дибромциклопропанов под действием метиллития.
Дибромпроизводные циклопропана получают присоединением дибромкарбена к алкену:
Рисунок 6.
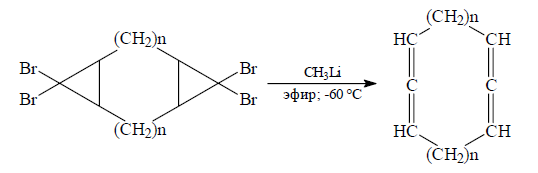
С помощью этого метода можно синтезировать циклические аллены, которые содержат девять и более атомов углерода в цикле:
Рисунок 7.
Термическое расщепление β-лактонов бутеновых кислот
Этот способ наиболее оптимален для получения тетраарилалленов.
Например: Пиролиз димера диметилкетена в атмосфере азота при 450º:
Рисунок 8.
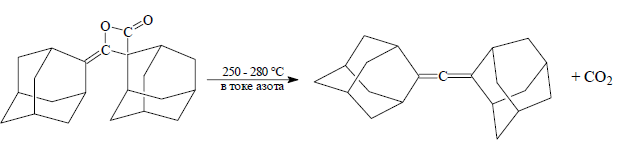
Аналогично можно получить аллен с двумя адамантильными группами
Рисунок 9.
Ацетилен - алленовая перегруппировка
Прототропная ацетилен - алленовая перегруппировка

Рисунок 10.
При таком способе получения алленов их доля в равновесной смеси с алкинами составляет всего 3-5%. Поэтому данный метод непригоден для промышленного синтеза.
Ацетилен - алленовая перегруппировка применяется при получении арилзамещенных алленов, которые содержат три арильные группы:

Рисунок 11.
Изомеризация в таком случае возможна при хроматографировании на основной окиси алюминия.
Ацетилен – алленовая перегруппировка, сопровождающаяся замещением галогена или сульфатной группы при α-углеродном атоме алкина, является распространенным методом получения алленов. Чаще для этого используют цинк-медную пару. Возможно, что в качестве интермедиата образуется цинкорганическое соединение, подвергающееся дальнейшему протолизу под действием спирта. Из ацетиленового и алленового хлоридов появляется смесь алкина и аллена в соотношении от 1:30 до 1:100.
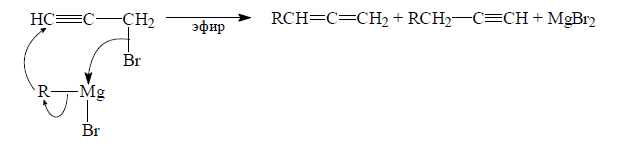
Кросс-сочетание пропаргилгалогенидов с литийорганическими или магнийорганическими соединениями. Это реакция бимолекулярного нуклеофильного замещения, сопровождающаяся ацетилен – алленовой перегруппировкой
Рисунок 12.
Продукты реакции – смесь алкина (24%) и аллена (63%):

Рисунок 13.
Соотношение продуктов реакции будет зависеть от наличия в реактиве Гриньяра микропримесей солей переходных металлов: кобальта, железа, меди и никеля. Литийорганические или магнийорганические соединения, не содержащие примесей переходных металлов, в реакциях с пропаргилгалогенидом дают смеси обоих углеводородов.
В реакциях конденсации пропаргилгалогенидов с магнийорганическими соединениями в присутствии треххлористого железа или треххлористого кобальта, получают преимущественно аллены.
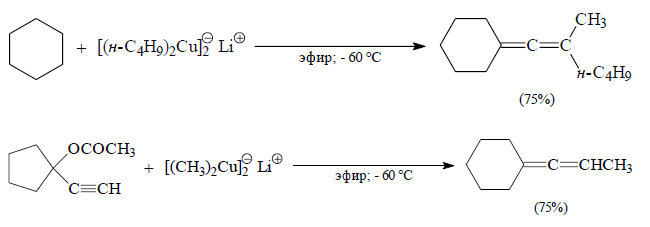
Кросс- сочетание пропаргилхлоридов, пропалгилацетатов или пропаргилсульфонатов с диалкилкупратами в пределах от -20 до -60ºС является самым эффективным способом получения ди- ,три-, тетраалкилалленов:
Рисунок 14.
Данная реакция является основой современных методов синтеза оптически активных алленов.