Молекула бензола симметричная и поэтому все атомы углерода абсолютно равноценны при образовании монозамещенных продуктов реакции. Если в бензольном ядре уже есть заместитель и мы вводим туда еще один, то при этом могут образовываться следующие орто- мета и пара- изомеры Положение, которое будет занимать следующий заместитель определяется природой начального заместителя (его $+/-І$ и +/-М эффектами). Согласно этому заместители можно разделить на две группы - заместители первого и заместители второго рода, в которые в свою очередь входят заместители оказывающие разные по знаку индуктивные и мезомерные эффекты.
Заместители первого рода
Заместители первого рода (орто и пара- ориентанты в реакциях замещения) - это атомы или группы атомов, которые являются донорами электронов. За исключением алкилных радикалов ($Alk-$) они имеют свободные электронные пары на атоме, который непосредственно связан с ароматическим ядром:
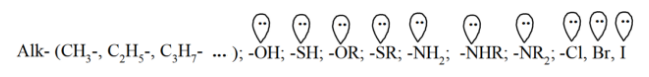
Обогащение ароматического ядра электронной плотностью ускоряет реакции электрофильного замещения.
Таким образом, механизм ориентирующего действия заместителей $I$ рода заключается в том, что они увеличивают степень делокализации положительного заряда $\sigma$-комплекса по сравнению с незамещенным $\sigma$-комплексом бензола. Это означает, что стабильность такого $\sigma$-комплекса возрастает, а энергия активации уменьшается, что приводит к ускорению реакции. Сравнение относительной стабильности о-, м- и $\pi-\sigma$ -комилексив рассмотрим на примере реакции $Se$ для фенола:
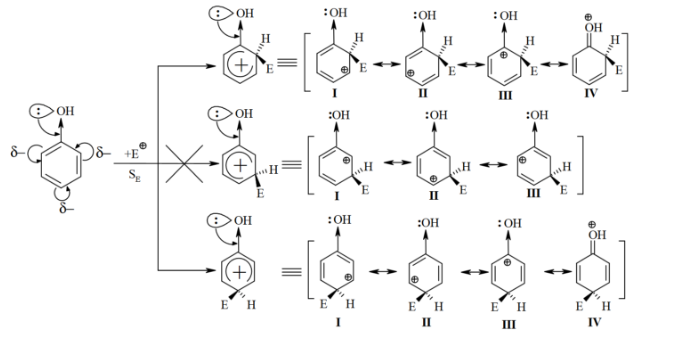
Приведенная схема показывает, что в случае орто- и пара- $\sigma$-комплексов делокализация заряда возможна благодаря четырем предельным структурам $(I-IV)$, тогда как в случае мета- $\sigma$-комплекса такая делокализация возможна только за счет трех пограничных структур $(І-III)$, поэтому реакция $SE$ идет преимущественно в орто- и пара- положения.
Заместители, которые проявляют $+I$-эффект
К заместителям, которые проявляют $+I$-эффект, относят менее электроотрицательные, чем углерод, атомы элементов: щелочные металлы; бор; группы атомов с полным отрицательным зарядом на атоме, соединенном непосредственно с углеродом; алкильные группы. $+I$-Эффект тем больше, чем левее и ниже расположены элементы в периодической таблице:

Для алкильных групп характерны слабые электронодонорные свойства и проявления их $+I$-эффекта зависит от структуры углеводородного остатка. Так, третичные алкильные группы проявляют больший, а первичные -найменший $+I$-эффект:
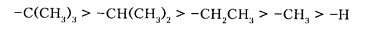
Заместители, которые проявляют +М-эффект
К таким заместителям в первую очередь относят анионы - сильные доноры электронов. В рамках одной группы элементов +М-эффект анионов уменьшается с увеличением заряда ядра атома:
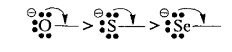
Для нейтральных атомов +М-эффект меняется с такой же последовательностью, однако его действие значительно меньше, чем для соответствующих анионов:
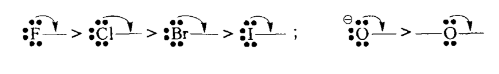
Данная закономерность связана с такими факторами:
- чем больше номер периода, в котором находится элемент, тем больше размер внешней $p$-орбитали и тем меньше возможность ее сопряжения с $p$-орбиталями углерода;
- с увеличением размера или крайней орбитали элемента ее средняя электронная плотность, а следовательно, и электронодонорные свойства этой орбитали уменьшаются.
В рамках периода +М-эффект также растет с уменьшением заряда ядра атома.
Кроме того, способность заместителя проявлять +М-эффект возрастает с понижением электроотрицательности атома.












