Энергии возмущений выражаются в единицах $\beta$ и отсчитываются от стандартных уровней $\alpha C$, которые соответствуют одиночным углеродным $2p$-орбиталям (поэтому им и присеваются индексы $C$ с индексами номера или положения) и называются несвязующими уровнями. Однако, при переходе от чисто углеродной $\pi$-системы к системе, содержащей гетероатомы, то кроме $\alpha C$ появляются вторые уровни, например для молекул содержащих кислород - $\alpha O$, которые соответствуют одиночным $2p$-орбиталям атомов кислорода. Поскольку уровни $\alpha O$ лежат ниже, то $\alpha C \neq \alpha O$, при образованиях $\pi$-орбиталей карбонильных групп $ >C=O$ происходят возмущения второго порядка (рис. 1).
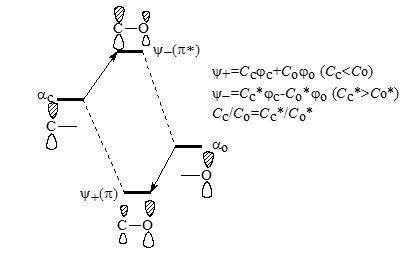
Рисунок 1. Возмущение второго порядка при образовании $\pi$-связи карбонильной группы. Между $\psi$+ и $\psi$- находятся несвязывающие орбитали неподеленных пар электронов атома кислорода
Карбонильная система
При возмущениях второго порядка связующие орбитали напоминают более низко расположенные базисные невозмущенные орбитали. Это влияет на коэффициенты и распределения электронных плотностей. Так в альдегидах коэффициенты $C_c C_o*$, причем $C_c/C_o=C_c*/C_o*$. Паре электронов на связующих орбиталях $\pi$ «смещены» к атомам кислорода, и на атомах кислорода $\pi$- заряд отрицательнее, а на атомах углерода положительнее, чем в нейтральных молекулах этилена:
$H_2C=CH_2$, $H_2C^{\delta+}=O^{\delta-}$
Плотности антисвязующех орбиталей $\pi$* больше на атомах углерода, чем на атомах кислорода.
Орбитали $\pi$ не являются высшими занятыми орбиталями карбонильной группы. У атома кислорода имеются две неподеленные пары электронов, которые занимают несвязующие, почти вырожденные, орбитали. Эти МО и будут высшими орбиталями. Локализации этих МО увеличивают общие отрицательные заряды на этих атомах. Реакции с электрофильными агентами (например, с протоном) идут с участием как раз этих насвязующих орбиталей:
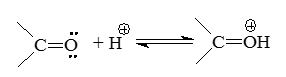
Рисунок 2.
$\pi$-Системы енолят-анионов (рис. 2) родственны аллильным $\pi$-системам:
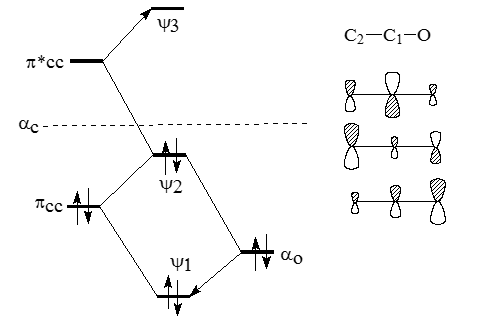
Рисунок 3. $\pi$-Орбитали енолят-аниона ацетальдегида
Связывающая $\pi$-орбиталь $\psi_1$ в основном принадлежит атому кислорода в полной аналогии с соответствующей орбиталью карбонильной группы (рис. 2.13); она расположена очень низко, поскольку оба возмущения, как со стороны орбитали $\pi_{CC}$ этиленового фрагмента, так и со стороны орбитали $\pi*_{CC}$, понижают уровень $O2p$. Орбиталь $\pi_{CC}$ расположена ближе к $O2p$, чем орбиталь $\pi*_{CC}$, и поэтому взаимодействует с $O2p$ сильнее, чем $\pi*_{CC}$. Это можно выразить следующей схемой:
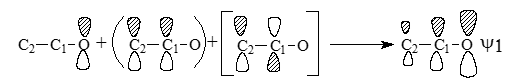
Рисунок 4.
Смысл схемы состоит в том, что орбиталь $\psi$1 образуется из орбитали $O2_p$ путем смешивания ее с орбиталями $\pi_{CC}$ и $\pi*_{CC}$ в фазе (знак «плюс»). Орбиталь $\psi_1$ по форме и по энергии похожа в первую очередь на $O2_p$, во вторую очередь - на $\pi_{CC}$ и имеет лишь слабое сходство с $\pi*_{CC}$. Действительно, $\pi*_{CC}$ имеет узел между $C_1$ и $C_2$, а $\psi_1$ такого узла не имеет. Влияние $\pi*_{CC}$ на форму орбитали $\psi_1$ угадывается лишь в том, что коэффициент при $C_2$ меньше, чем при $C_1$, так как $\pi*_{CC}$ подмешивается к $\pi_{CC}$ в области атома $C_2$ в противофазе, а в области атома $C_1$ - в фазе соответствующих $p$-функций.
Орбитали $\psi_2$ и $\psi_3$ образуются следующим образом:
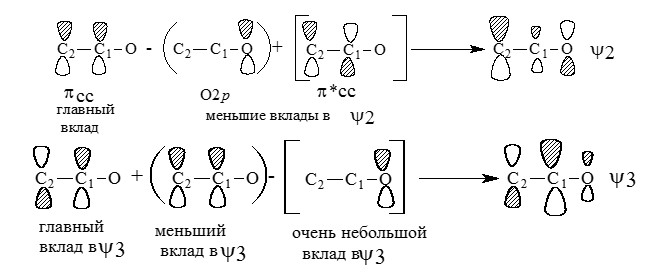
Рисунок 5.
Ароматичность и конкурентные внутримолекулярные взаимодействия в полизамещенных нитроаминобензолах
Рассмотрим более сложные гетероатомные системы.
Рассчитаны геометрические и энергетические параметры, индексы ароматичности и энергии деформации для серии производных бензола с разным количеством и расположением нитро- и амино- заместителей, характеризующихся сильными электронными эффектами ($\pi $-акцепторными и $\pi $-донорными соответственно). Влияние нескольких заместителей на молекулярную структуру и ароматичность бензольного цикла в гомо замещенных молекулах невелико и хорошо согласуется с моделью индуктивной поляризации электронной системы. Вместо этого исследования изомеров нитроанилина показали, что ароматичность орто-изомера существенно ниже ароматичности мета- и пара-изомеров (индекс HOMA равна $82\%$, $88\%$ и $92\%$ соответственно) . Такие изменения не согласуются с общепринятой моделью совокупного влияния $\pi $-донорного и $\pi $-акцепторного заместителей, предусматривающий пуш-пульного взаимодействия с переносом заряда через $\pi $-систему в орто- и пара-изомеры, в отличие от мета-изомера. Анализ распределения электронной плотности методами AIM показал наличие внутримолекулярной водородной связи $N-H$ ... $O-N$ в орто-иозмере между соседними заместителями. Эта связь является вероятно резонансно-усиленной и привлекает $\pi $-электроны цикла, объясняет снижение его ароматичности (рис.3).
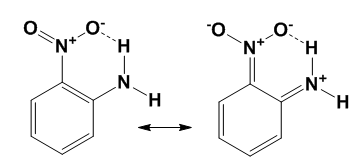
Рисунок 6. Канонические резонансные структуры орто-нитроанилина
Анализ характеристик водородных связей показал, что расстояние $N-H$ ... $O-N$ сокращается от $1.957 E$ в орто-нитроанилина к $1.703 E$ в триаминотринитробензоле. Суммарная энергия водородных связей в молекуле, оценена по формуле Эспинозы, растет нелинейно. В пересчете на одну связь она увеличивается от $8$ до $14$ ккал / моль. Это является признаком наличия кооперативного эффекта для большого количества связей. Образование одной водородной связи нарушает сопряжения в ароматическом цикле, что способствует участию $\pi $-электронов ароматического системы в резонансном усилении каждого следующего связи. Также это уменьшает ароматичность и таким образом способствует увеличению чувствительности $\pi $-системы бензольного кольца к другим электронным эффектам различной природы. Для молекул с тремя и более водородными связями характерна некоторая непланарнисть бензольного кольца в основном состоянии (торсионные углы составляют $1^\circ$ - $5^\circ$) и очень низкое значение энергий деформации ($0.6 - 3.7$ ккал / моль), что согласуется с их низкой ароматичность.
Влияние заместителей на ароматичность моно-гетероциклических аналогов бензола
Были рассчитаны индексы ароматичности и геометрические параметры монозамещенных нитро- и аминогрупп моногетероциклических аналогов бензола. Тенденции более выраженного влияния донорных заместителей на сравнение с акцепторами подтверждаются и в этом случае. В отличие от нитроаминопроизводных бензола, наиболее существенным фактором, влияющим на характеристики молекул, является пуш-пульный эффект в аминопроизводных гетероциклов с электроотрицательными гетероатомами ($N$, $O^+$, $S^+$, $Se^+$), особенно с заряженными заместителями. Он включает перенос положительного заряда из гетероцикла на аминогруппу и резонансную поляризацию $\pi $-системы цикла. Этот эффект аналогичен пуш-пульному взаимодействию $\pi $-донорного и $\pi $-акцепторного заместителей, расположенных в орто- или пара-положениях. Он проявляется в снижении ароматичности и изменениях молекулярной геометрии хиноидного типа: так, индексы ароматичности в $2^-$ и $4^-$ аминопроизводных таких гетероциклов значительно меньше $3$-аминопроизводных, связи $С-NH_2$ в них выражено меньше, а $C(2)-X$ - длиннее. Наиболее выраженной эта тенденция в аминопроизводных катиона пирилия - цикла из самых электроотрицательным гетероатом (рис. 4).
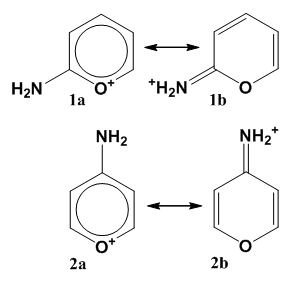
Рисунок 7. Пуш-пульный эффект в катионах $2$ и $4$-аминопирилия
При том, что энергия ароматической стабилизации (как и другие индексы ароматичности) в 3-аминопроизводных выше, общая стабильность этих изомеров ниже. Так, разница их энергий Гиббса с $2$ и $4$-изомерами составляет $10 - 11$ ккал/моль для аминопроизводных пирилия, $4-5$ и $3-5$ ккал/моль для производных, соответственно, тио- и селенопирилия, и $3-5$ ккал/моль для производных пиридина. При этом разница в энергиях между изомерными аминопроизводными всех других гетероциклов и всеми изомерными нитропроизводными не превышает $2$ ккал/моль. Таким образом, в некоторых замещенных гетероциклических аналогах бензола ароматичность является дестабилизирующим фактором, принципиальным образом противоречит классическим представлениям об энергетической стабилизации ароматических соединений.


















