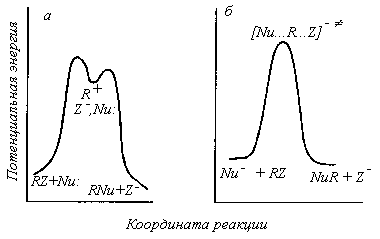
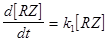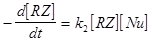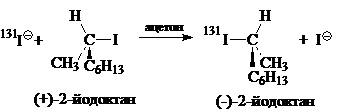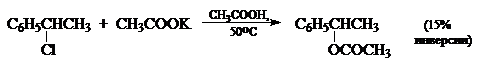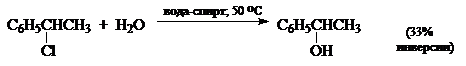В классическом ионизационном механизме $S_N1$ Ингольда—Хьюза стадией, которая определяет скорость реакции является стадия гетеролитической диссоциации, которая ведет к образованию свободных трехкоординированных карбокатионов и уходящих групп. Далее следует быстрая рекомбинация электрофильных карбокатионов с любыми основаниями Льюиса (нуклеофилами), которые находятся в растворе, включая и сам растворитель. Этим реакциям соответствуют энергетические диаграммы, представленные на рис. 1:.
Рис. 1. Энергетические диаграммы для предельных случаев механизмов $S_N1$ (a) и $S_N2$ (б). Переходные состояния $S_N2$-механизма (в)
Закономерности протекания реакций по механизму $S_N1$
Такие диссоциативные реакции имеют следующие характерные следствия:
-
Поскольку стадия ионизации определяет скорость всей реакции, реакции подчиняются кинетическому уравнению первого порядка:
скорость =
Таким образом скорости ионизации субстратов не должны зависеть ни от природы, ни от концентраций нуклеофильных реагентов $Nu:$.
-
Из энергетических диаграмм следует, что энергии переходных состояний стадий ионизации $R—Z$ близки к энергиям продуктов первой стадии - карбокатионов. Следовательно, переходные состояния «похожи» на карбокатионы и в структурном смысле, тогда структурные взаимодействия, которые понижают энергии карбокатионов, должны понижать и энергию переходных состояний.
- Ионизация зависит как от полярности и ионизирующих сил растворителей, так и от присутствия в растворах ионов $Z^-$, которые влияют на диссоциацию.
- Если карбокатионы, образующиеся при ионизации, достаточно стабильны, они примут плоскую конфигурацию, которая ахиральна и наиболее выгодную энергетически.
Закономерности протекания реакций по механизму $S_N2$
В классическом $S_N2$ механизме замещения описывается синхронная одностадийная реакция, в которой переходные состояния представляют собой тригональные бипирамиды с пентакоординированными атомами углерода (рис.1). В $S_N2$-механизме отсутствует какой-либо интермедиат в процессе согласованного замещений групп $Z$ на $Nu$ (рис.1).
В таких процессах главными энергетическими факторами являются взаимодействия несвязывающих орбиталей нуклеофилов (ВЗМО) с разрыхляющими $\sigma$*-орбиталями связей $C-Z$ (НСМО).
Такой механизм имеет следствия:
-
Реакции имеют общий второй кинетический порядок:
скорость =
Нуклеофилы участвуют в образовании переходных состояний, поэтому скорость должна зависеть как от концентрации, так и от природы нуклеофилов, что резко отличает $S_N2$ механизм от механизма $S_N1$.
-
Синхронные $S_N2$-реакции должны быть стереоспецифическими. Атака нуклеофилов наблюдается с тыла. Нуклеофильные агенты $Nu$: атакуют субстраты $RZ$ со стороны, противоположной уходящим группам $Z$, таким образом, чтобы образование связей $C—Nu$ сопровождается синхронными расщеплениями связей $C—Z$ в тригональных бипирамидальных переходных состояниях с пентакоординированными атомомами углерода (рис. 1,в).
Примером этого процесса, является замещение атомов йода в $(+)-2$-йодалканах под действием радиоактивных йодид-ионных изотопов (Ингольд, Хьюз, 1935):
Каждому элементарному акту замещения атомов йода на изотопы соответствует обращение (инверсия) конфигураций.
-
В переходных состояниях согласованных $S_N2$-реакций степень координации центральных атомов углерода увеличиваются до пяти, а сами переходные состояния представляют собой тригональные бипирамиды. Исходя из этого, скорости таких реакций должны быть в очень сильной степени чувствительны к пространственным факторам, в первую очередь к объемам заместителей при центральных атомах углерода. Скорости $S_N2$-реакций для алкилгалогенидов, а также алкилсульфонатов уменьшаются в ряду первичный - вторичный – третичный заместитель:
$CH_3 > C_2H_5 > RCH_2 > R_2CH > R_3C$.
Процессы, в которых затруднено определение типа механизма реакции
Тем не менее, в процессах сольволиза, когда роль нуклеофилов играют сами растворители, концентрация которых в ходе реакций практически не изменяется, скорости реакций подчиняются кинетическому уравнению первого порядка даже в том случае, когда истинные механизмы сольволиза относится к $S_N2$-типу. Такие процессы будут иметь «псевдопервый» порядок. Следовательно, отсутствуют кинетические критерии выбора механизмов сольволиза.
Стереохимия нуклеофильного замещения также не всегда дает однозначный ответ при выборе между ионизационным и согласованным механизмами, в особенности для бензил- и бензгидрилгалогенидов, например:
Наблюдаемые частичные инверсии затрудняют отнесение этих реакций к какому-либо из предельных механизмов. Можно представить даже такой случай, когда реакции проходят со 100%-й инверсией, но другие данные свидетельствуют в пользу ионизационного механизма. Особенно трудно решить вопрос о механизме для таких соединений, как втор-алкилгалогениды, сульфонаты и бензилгалогениды. Они ведут себя так, как будто для них механизм является формально промежуточным между $S_N1$- и $S_N2$ механизмами.