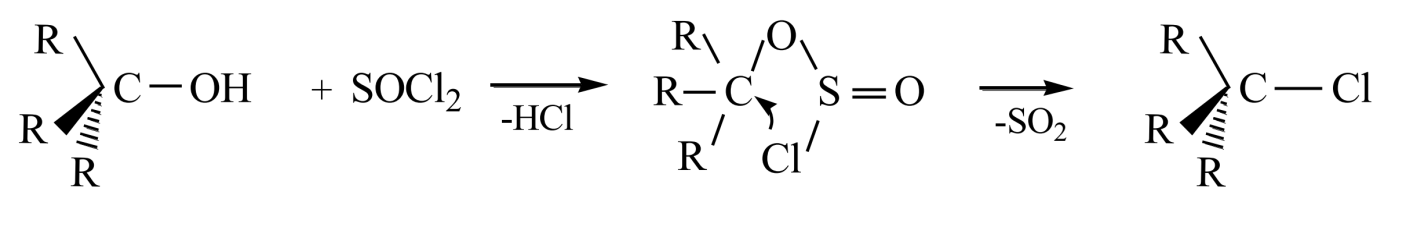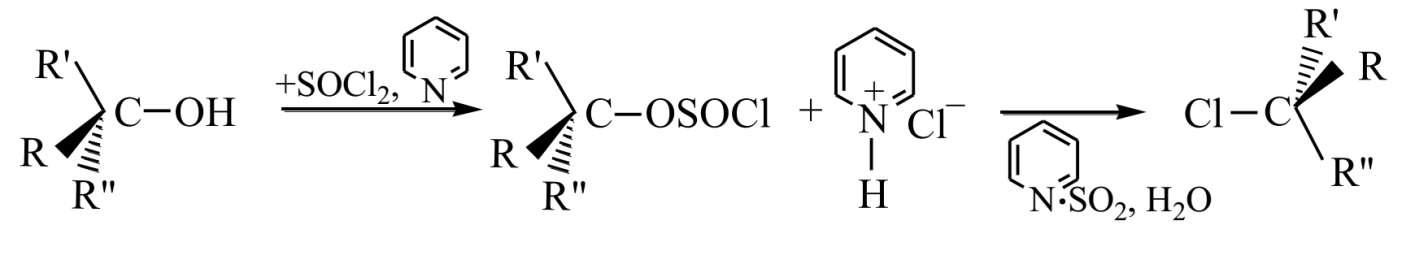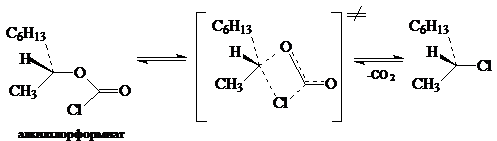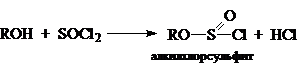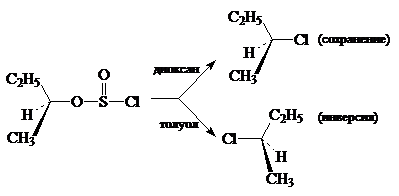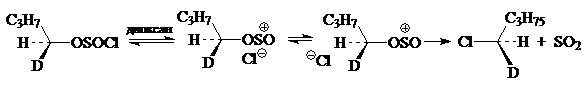Несколько особняком от рассмотренных ранее реакций нуклеофильного замещения стоят реакции, протекающие с сохранением конфигурации. Конкретным случаем такой реакции является замещение $OH$ группы на хлор в присутствии тионилхлорида. Эта реакция подчинена кинетическому уравнению второго порядка и пропорциональна:
$[RHal]\cdot [SOCl2]$
Но поскольку вращение конфигурации отсутствует, то такую реакцию нельзя отнести к реакциям $SN2$ механизм эти реакции интерпретируют так:
На первой стадии изменение конфигурации не происходит, а на второй стадии атака хлором проходит с той же стороны. причем такая реакция напоминает механизм $SN1$, когда распад проходит через ионную пару с быстрой атакой атомом галогена. В результате реакции образуется продукт, конфигурация которого аналогична конфигурации исходного спирта.
Особенности SNi механизма
Механизм такой реакции принято обозначать $SNi$ - внутреннее нуклеофильное замещение. Когда же реакцию проводят в присутствии пиридина, то гидрогенхлорид, который выделяется на первой стадии, дает хлоранион, легко атакующий алкилсульфохлорид с обратной стороны молекулы и вытесняет -$OSOCl$. Тогда это будет классическая реакция $SN2$.
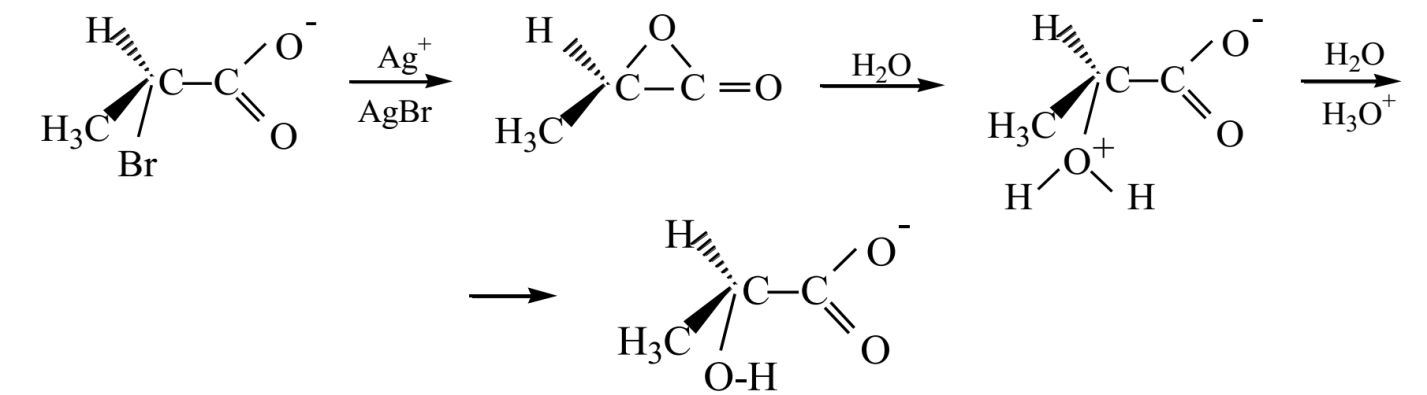
Известно множество других реакций замещения, при которых наблюдается сохранение конфигурации. Можно считать, что для всех этих реакций характерным является тот факт, что наряду с реакционным атомом углерода расположен атом, который несет некоторый негативный заряд или обладает неразделенной парой электронов. Поэтому такой атом может выступать "внутренним" нуклеофилом. В частности, во время гидролиза 2-бромпропионовои кислоты в присутствии иона серебра отрицательно заряженный кислород выступает как внутренний нуклеофил и замещает бром по механизму $SN2$ с образованием лактона. Эта стадия проходит с вращением конфигурации. На следующей стадии вода атакует лактон, осуществляя вторую $SN2$ реакцию, а второе вращения конфигурации приводит к той же конфигурации, что и в исходной соединения.
Рассмотрение закономерностей протекания SNi механизма
Для рассмотрения этого механизма представляется реакция нуклеофильного замещения, которая имеет первый кинетический порядок, но тем не менее протекает с сохранением конфигураций у центрального атома углерода. Например, сохранение конфигурации очень часто наблюдается в реакциях разложения вторичных алкил- хлорформиатов. Для объяснения этого стереохимического результата, Ингольд и Хьюз в свое время предположили, что эти реакции протекают через циклические четырехцентровые переходные состояния, и механизм реакций такого типа был обозначен символом SN i (internal nucleophilic substitution):
В случае замещения по механизму $SNi$ замена нуклеофила как правило не приводит к изменению скорости реакции. Относительно группы, отщепляется в реакции $SNi$, можно утверждать, что связь этой группы с карбоном разрывается легче в случае образования соответствующего переходного состояния. Скорость реакции, которая протекает по механизму $SNi$, зависит от природы группы, отщепляется. Чем ниже энергия связи этой группы с активированным атомом углерода, тем выше способность группы образовывать анион и тем легче проходит реакция по механизму $SNi.$
Влияние растворителя на протекание реакций по SNi механизму
Другим примером реакций идущих по $SNi$ механизму являются реакции разложения алкилхлорсульфитов, которые образуются при действии на спирт жидкого или газообразного хлористого тионила:
Алкилхлорсульфит разлагается на $RCl$ и $SO_2$, при этом сохраняется его конфигурация. Однако данные реакции не идут через четырехцентровые переходные состояния, а осуществляются совершенно иным путем. Степень сохранения или изменения конфигураций зависит от растворителя (его природы и соответственно полярности и нуклеофильности). Так, для оптически активного втор-бутилхлорсульфита в диоксане разложение происходит с практически полным сохранением конфигурации, но в толуоле этот процесс происходит почти с полной инверсией:
Чтобы объяснить такие резко противоположные влияния рас-творителей, был предложен ион-парный $SN1$-механизм, включающий ионизацию связей $S^-Cl$ и определяющий скорости стадий.
Дальнейший путь превращений образующихся ионных пар зависит от природы раство-рителя. Если растворитель обладает достаточными основными свойствами, он может стабилизировать ионные пары, сольватируя их с обратной стороны. Последующие внутренние превращения приводят к сохранению конфигурации. Растворители с низкой сольватирующей способностью (например, толуол) не могут стабилизировать ионные пары, и происходит замещение ионом $Cl^- SO_2$ с обратной стороны молекулы:
Такой механизм согласуется с наблюдением преобладающей инверсии при разложении первичного оптически активного хлорсульфита даже в диоксане. В этом случае стабилизирующее влияние молекулы диоксана значительно менее эффективно, так как первичный атом углерода не превращается в карбокатион:
Ясно, что $SNi$-механизм является специальным случаем $SN1$-механизма, в котором уходящая группа имеет сложное строение.