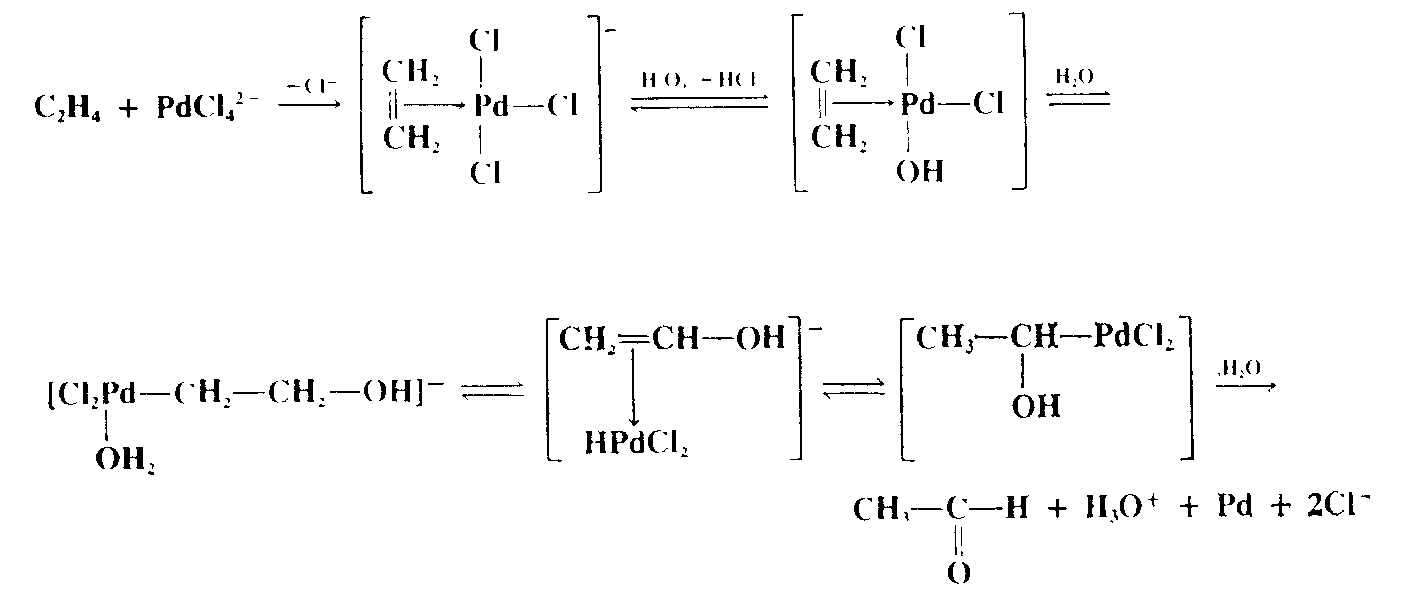В органической химии скорее в результате развития традиций, а не по формальному соглашению функциональные группы располагают (на качественной основе) в порядке возрастания их степени окисления, и тогда окисление определяют как процесс, при котором в результате превращения функциональной группы соединение переходит из одной категории в долее высокую. Восстановление представляет собой процесс, обратный окислению.
Естественно, что любое окисление сопровождается восстановлением. Однако при классификации реакций учитывается, окисляется или восстанавливается при этом органическое соединение.
Механизмы окисления
Необходимо отметить, что приведенное определение окисления не имеет никакого отношения к механизму. Основная причина заключается в следующем: механизмы этих реакций весьма разнообразны, что в свою очередь обусловлено значительными различиями в изменении характера связей.
При окислительном и восстановительном изменении связей они значительно более разнообразны. Другая причина заключается в том, что механизм конкретной реакции окисления или восстановления может сильно изменяться в зависимости от природы окислителя или восстановителя. Часто механизм реакций оказывается тщательно изученным только для одного или нескольких из используемых для данного превращения реагентов.
Механизмы реакций окисления и восстановления возможно разде-лить на несколько категорий, каждая из которых охватывает широкий круг реакций:
-
Прямой перенос электрона . Реакции, в которых восстановление представляет собой непосредственное принятие электронов, а окисление — непосредственную их потерю. Примером может служить восстановление по Бёрчу, в котором происходит прямой перенос электронов от натрия к ароматическому кольцу. Такой механизм присущ в основном реакциям трех типов:
- окислению или восстановлению свободных радикалов (окисление до положительного иона пли восстановление до отрицательного иона);
- окислению отрицательно заряженного иона до относительно устойчивого свободного радикала;
- реакциям электролитического окисления или восстановления например, реакции Кольбе.
-
Гидридный перенос. В некоторых реакциях гидрид-ион переносится от субстрата или к нему. Примером может служить восстановление эпоксидов под действием алюмогидрида лития. Другой пример — реакция Канниццаро. К этой же категории относятся реакции, в которых гидрид-ион отщепляется под действием карбокатиона :
- Перенос атома водорода. Многие реакции окисления и восстановления представляют собой свободнорадикальное замещение и включают перенос атома водорода.
- Образование сложноэфирных интермедиатов. Ряд реакций окисления протекает через образование сложноэфирных интермедиатов (обычно это эфиры неорганических кислот) с последующим расщеплением этого интермедиата.
-
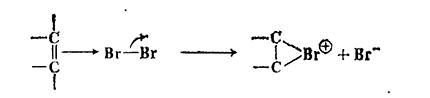
Механизм замещения. В таких реакциях под действием электронов органического субстрата происходит замещение в электрофильном окислителе. Один из примеров — присоединение брома к олефину, уже рассмотренное раньше.
-
Механизм присоединения — отщепления. При таком взаимодействии окислитель присоединяется к субстрату, а затем часть его отщепляется.
Окисление олефинов до альдегидов и кетонов
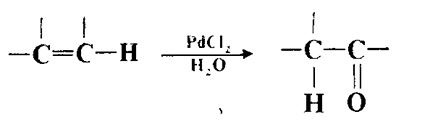
Монозамещенные и 1,2-дизамещенные олефины окисляются в альдегиды и кетоны хлоридом палладия, а также галогенидами других благородных металлов. В случае 1,1-дизамещенных олефинов обычно получаются неудовлетворительные результаты. Реакция используется в промышленности для синтеза ацетальдегида из этилена (Вакер-процесс), но она пригодна и для лабораторного применения.
Хлорид палладия восстанавливается до палладия. Ввиду высокой стоимости реагента реакцию обычно проводят в присутствии соокислителя, чаще всего $CuCl_2$, функция которого состоит в реокислении $Pd \ в \ Pd(II)$. $Сu$ восстанавливается до $Cu(I)$. Соединения $Cu(I)$ окисляются до $Cu(II)$ кислородом воздуха, поэтому единственным расходуемым окислителем является воздух. В реакции вводились и другие соокислители, среди которых $O_3, Fe_3^+ \ и \ PbO_2$. Альдегид в качестве основного продукта получается только из этилена. Для других олефинов соблюдается правило Марковникова и образуются в основном кетоны. Общепринятая схема механизма включает $\pi$-комплексы палладия:
Этот механизм объясняет факт, обнаруженный в экспериментах с дейтериевыми метками, согласно которому все четыре атома водорода, входящие в состав ацетальдегида, происходят из этилена, а не из растворителя.
Аналогичные реакции проводились и с другими окислителями. Окисление $Me_2C=CMe_2$ системой трифтороперуксусная кислота — трифторид бора приводит к $Me_3CCOMe$ (пинаколин) путем миграции не водорода, а алкильной группы. Эта реакция представляет собой эпоксидирование с последующей перегруппировкой эпоксида. Процесс эпоксидирования подробнее будет рассмотрен далее. Применялись и другие окислители — хромилхлорид, нитрат таллия (III) — метанол, диизоамилборан с последующей обработкой хлорохроматом пиридиния, $H_2O_2$ в присутствии палладиевого катализатора, $O_2$ в присутствии катализатора, $CrO_3 — H_2SO_4$ — соли $Hg (II)$, сульфат ртути — вода и ацетат ртути с последующей обработкой хлоридом палладия (II).
Алкены превращаются также в продукты более глубокого окисления. Примерами могут служить следующие реакции:
- действие $KMnO_4$ в водном ацетоне, содержащем уксусную кислоту, приводит к гидроксикетонам;
- 1,2-дизамещенные и тризамещенные алкены дают $\alpha$-хлорозамещенные кетоны при окислении хромилхлоридом в ацетоне:
- перманганат калия в уксусном ангидриде окисляет макроциклические циклоалкены в 1,2- дикетоны.
Фотооксигенирование
Интересным развитием аллильного окисления служит использование синглетного молекулярного кислорода как в лабораторной практике, так и в промышленности. Фотооксигенирование, сенсибилизированное красителем (например, бенгальским розовым, флуоресцеином, метиленовым голубым), является наиболее часто применяемым вариантом, однако реагент может быть получен и другими путями, в частности термическим разложением аддукта трифенилфосфита с озоном или по реакции гипохлорита натрия с пероксидом водорода. В результате часто достигаются прекрасные выходы эллильных гидропероксидов и производных спиртов, а продукты, полученные этим методом, не всегда удается получить другими путями.