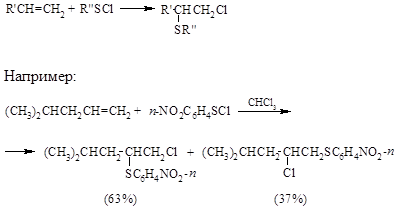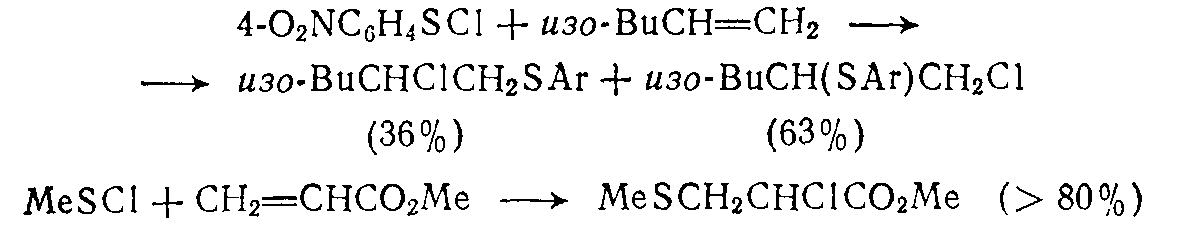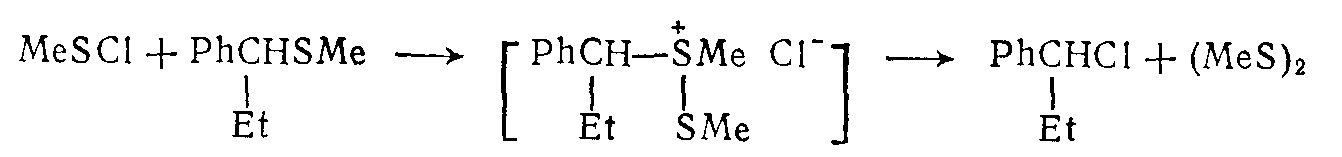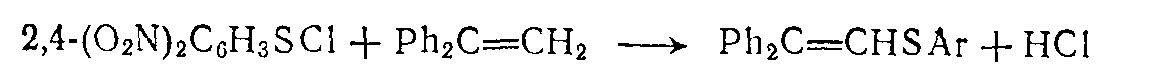Сульфенилгалогениды или сульфенгалогениды $RSHal$ обычно используют для получения других производных сульфеновых кислот. Наиболее известными и стабильными соединениями этого класса являются сульфенилхлориды. Писутствие в молекуле электроноакцепторных групп увеличивает, а наличие $\alpha$-водородных атомов уменьшает их стабильность. Алкансульфенилхлорнды обычно представляют собой жидкости желтого цвета, ароматические производные жидкости оранжево-красного цвета или желтоватые кристаллы все сульфенилгалогениды обладают раздражающим действием.
Взаимодействие ковалентных сульфенгалогенидов $RSCl$ и $RSBr$ с алкенами длительное время считалось одной из самых простых $AdE$-реакций алкенов. Присоединение сульфенгалогенидов дает $\beta$-галогентиоэфиры с выходами, близкими к количественному. При этом не наблюдается образованием продуктов сопряженного присоединения растворителя, даже уксусной кислоты или ацетонитрила, и не осуществляются скелетные перегруппировки, Стереохимия реакции присоединения $RSCl$ и $RSBr$ практически всегда соответствует анти-присоединению групп $RS-$ и галогена, а ее региоселективность – преимущественному антимарковниковскому присоединению для терминальных алкенов (1-алкенов):
Для замещенных стиролов, однако, присоединение сульфенгалогенидов протекает в полном соответствии с правилом Марковникова.
Электрофильное присоединение
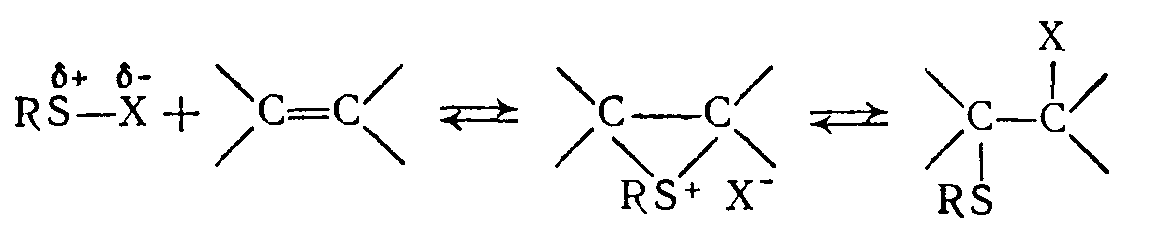
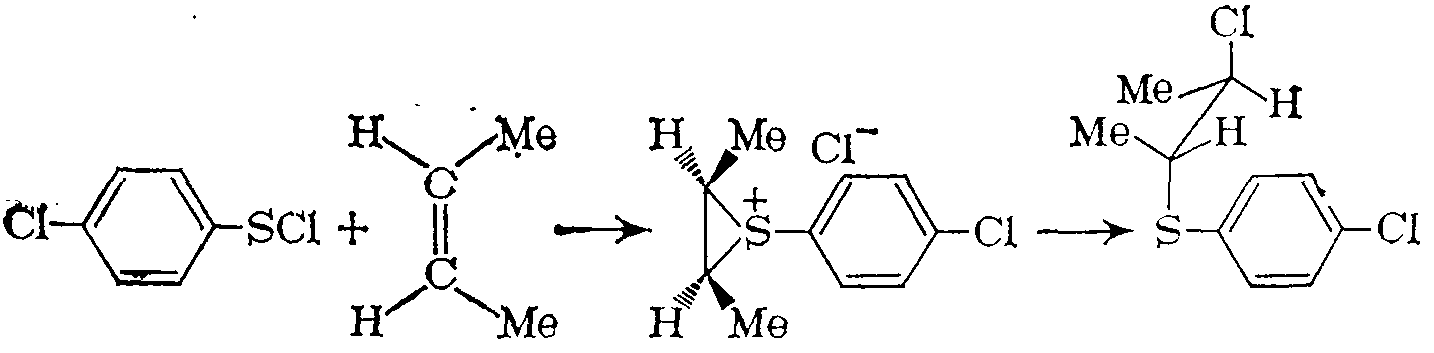
Сульфенилгалогениды гладко присоединяются к алкенам с образоваанием $\beta$-хлорсульфидов. Считают, что эта реакция проходит по механизму $AdE_2$, в котором катионный интермедиат представляет собой эписульфониевый ион, и приводит, как правило, к стереоспецифическому транс-присоединению:
Скорость реакции присоединения очень сильно возрастает при увеличении полярности растворителя, что находится в соответствии с предлагаемым полярным механизмом реакции.
Скорость реакции присоединения очень сильно возрастает при увеличении полярности растворителя, что находится в соответствии с предлагаемым полярным механизмом реакции. Значения функции Гаммета для присоединений к замещенным стиролам ($p^+ = -2,4$) и в реакциях с 4-замещенными 2-нитробензолсульфенилгалогенидами ($p^+ = -0,7$) указывают на делокализацию положительного заряда на атомах углерода и серы. Показано, что стереоспецифичность транс-присоединения п-хлорбензолсуль- фенилхлорида к $(E)^-$ и ($Z$) -бутенам-2 сохраняется в интервале температур 180 °С. Такая стереоспецифичность наблюдается в реакциях многих алкан-, арен-, ацил- и амино-$N$-сульфенилгалогенидов и алкенов. Теоретические расчеты для иона $C_2H_4SH^+$ показывают, что мостиковый эписульфониевый ион будет более стабилен в качестве интермедиата, чем линейный карбениевый ион. Однако в некоторых случаях стабильность эписульфониевого иона может существенно уменьшиться и присоединение при этом проходит с участием открытого карбение- вого иона, что приводит к потере стереоспецифичности. Примерами таких реакций являются присоединение 2,4-динитробензолсульфенилхлорида к цис-ацетолу $n-МeOC_6H_4CH=CHMe$, а также взаимодействие бензолсульфенилхлорида с напряженными циклобутенами.
Стадией, определяющей соотношение продуктов, образующихся в реакции электрофильного присоединения («продуктопределяющей» стадией), является стадия взаимодействия галогенид-иона с эписульфониевым ионом. При кинетическом контроле со став продуктов реакции будет отражать относительную скорость замещения по углеродным атомам кольца эписульфониевого иона. Наличие α-заместителей, увеличивающих реакционную способность в реакциях типа $Sn^2$ ($Ph$, $COX$, $CN$ или $CH=CH_2$), приведет к увеличению относительной скорости реакции по соседнему углеродному атому; алкильные группы или другие объемность заместители будут уменьшать относительную скорость реакции.
В силу этого терминальные алкены образуют преимущественно аддукты антимарковниковского типа, стиролы и производные акриловой кислоты — продукты присоединения по правилу Марковникова, а диены — продукты 1,2-присоединения по правилу Марковникова. Электроотрицательные заместители в сульфенилгалогенидах уменьшают относительную стабильность эписульфониевого иона, что приводит к увеличению $Sn^1$-характера продуктопределяющей стадии и увеличению количества аддукта, образующегося по правилу Марковникова. Образующиеся аддукты при стоянии в кислой или полярной среде обычно перегруппировываются в термодинамически более стабильный изомер. На примере аддуктов, образующихся с (2)-циклооктеном и $N$-аминосульфенилгалогенидами была показана обратимость реакции электрофильного присоединения,
Взаимодействие сульфенилгалогенидов с алкил сульфида ми приводит к алкилгалогенидам в тех случаях, когда при расщеплении связи $C—S$ образуются стабильные карбокатионы. Реакции такого типа могут происходить с продуктами присоединения сульфенилгалогенидов к алкенам при использовании избытка сульфенилгалогенида.
При реакции сульфенилгалогенидов, особенно при наличии в них электроотрицательных заместителей, с разветвленными олефинами конечным результатом может оказаться полное электрофильное замещение.
Механизмизм присоединения сульфенгалогенидов
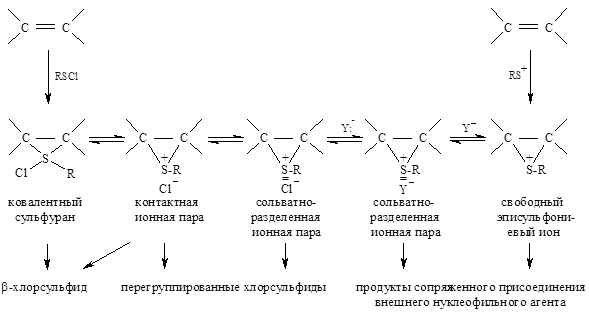
Полагают, что во всех подобных случаях реакции присоединения происходят по аналогичным механизмам. Для наиболее полного описания механизма присоединения как ионных ($RS^+$), так и ковалентных ($RSCl$) реагентов Н.С. Зефировым и В.А. Смитом была предложена общая схема, предполагающая образование в качестве интермедиатов различных типов ионных пар, эписульфониевого иона и ковалентного сульфурана.
Преимущественное присоединение по правилу Марковникова происходит в тех случаях, когда условия реакции и заместители благоприятствуют образованию высокополярного интермедиата на стадии образования продукта. При присоединении против правила Марковникова, по-видимому, происходит распад первоначально образующегося интермедиата.
Эта схема, в сущности, является расширенным приложением схемы Уйнстейна для описания реакций мономолекулярного нуклеофильного замещения $Sn^1$-типа у насыщенного атома углерода.