Свободные радикалы
Свободные радикалы - это незаряженные частицы с ферромагнитными свойствами, которые обусловлены магнитным моментом неспаренного электрона. К свободным радикалам относят также некоторые атомы (водород, галогены) и азотсодержащие соединения, которые имеют на одном из атомов азота свободный электрон. Радикалы сказываются точкой (•), и условно их делят на $\sigma^-$ и $\pi$-радикалы.
Стабильность радикалов
Сильные радикалы, как и другие промежуточные частицы, очень реакционные, и время их существования мало. Различают термодинамическую и кинетическую стабильность свободных радикалов. Термодинамическая стабильность существует вследствие делокализации электронов, которая снижает энтальпию образования свободного радикала. Термодинамическая стабильность измеряется разностью энергий С-Н-связи в молекуле предшественника радикала и С-Н-связи соответствующего соединения.
Кинетическая стабильность радикалов обусловлена в первую очередь влиянием пространственных препятствий на реакционную способность. Так, для 2,4,6-три-трет-бутилфеноксил-радикала объемные трет-бутил- группы, размещенные в о положениях к атому углерода, у которого находится кислород из неспаренных электронов, мешают его взаимодействия с другими реагентами:
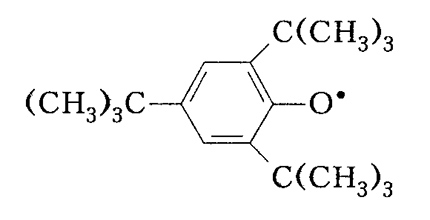
При значительных размерах таких заместителей подобные радикалы могут существовать в нормальных условиях как обычные соединения в растворах или в твердых телах. Иногда вместо терминов "термодинамическая" и "кинетическая" стабильность предлагают эквивалентные по содержанию термины соотнесенные к времени жизни радикалов - соответственно "короткоживущие" и "долгоживущие". Термодинамическая стабильность характерна для короткоживущих радикалов, а кинетическая стабильность - для долгоживущих. Кроме того, короткоживущие радикалы проявляют достаточно широкий спектр реакционной способности. Поэтому не следует путать понятия реакционной способности радикала со временем его существования ("живучести"), между которыми четкой корреляции не существует. Так, чрезвычайно реакционноспособен метил-радикал становится долгоживущим (стабильным), если его максимально изолировать от влияния среды. Частицы, которые характеризуются двумя неспаренными электронами, называются бирадикалами, например:

Высокую реакционную способность имеют радикалы метилилидена и его производные – карбены, в которых неспаренные электроны расположены на одном атоме углерода.
Карбены
Карбенами называют нейтральные нестабильные частицы с двухкоординационным углеродом общей формулы $R^1 –C$: –$R^2$, где атом углерода содержит только шесть валентных электронов.
Существует также ряд других реагентов, называемых «карбеноидами», которые качественно имитируют некоторые реакции карбенов, хотя не включают свободные двухвалентные частицы.
Карбены сопоставлены с другими промежуточно-образующимися частицами. Карбены в триплетном состоянии можно рассматривать как бирадикалы, хотя наличие двух неспаренных электронов. У одного атома углерода может сообщать некоторую специфичность таким частицам. Карбены в синглетном состоянии представляют собой частицы, обладающие дефицитом электронов, что роднит их с ионами карбония. С другой стороны, аналогично карбанионам они обладают свободной парой электронов. Поэтому карбены в синглетном состоянии могут иметь или электрофильный, или нуклеофильный характер в зависимости от способности групп, смежных с карбеноидным углеродом, оттягивать или нагнетать электроны.
Номенклатура карбенов
Термин «карбен», предложенный Дёрингом, Уинстейном и Вудвордом, впервые прозвучал в 1951 г. на 119 заседании Американского химического общества. Это название хорошо подходит для обозначения класса реакционноспособных соединений двухвалентного углерода. Для названия более сложных по своему строению соединений термин «карбен» используется аналогично термину «карбинол» в соответствующей системе номенклатуры. В случае циклических карбенов возникающие трудности номенклатуры можно обойти, вводя префикс «карбена-», которым далее можно пользоваться так же, как приставками «аза», «окса» и т. д.
Номенклатура, базирующаяся на термине «карбен», противоречит правилам, установленным Комитетом по номенклатуре органических соединений при Международном союзе теоретической и прикладной химии (ИЮПАК). Согласно этим правилам, вещества, существующие лишь промежуточно, следует классифицировать как радикалы. Для наименования радикалов с фрагментом $=С$: следует пользоваться окончанием «илиден».
«Илиденовую» номенклатуру не удается последовательно употреблять, если хотя бы одна из связанных с двухвалентным атомом углерода групп является алкильным радикалом. Для таких соединений названия должны основываться на слове «метилен», которое в этом случае является синонимом термина «карбен». Названия в соответствии с «илиденовой» системой не указывают местонахождения двухвалентного углерода в молекуле. Более того, эта система может ввести в заблуждение, так как термин «илиден» часто употребляют для обозначения соединений, не содержащих двухвалентного углерода (например, циклогексилиденциклогексанон). Правда, в этом случае частица «илиден» не является окончанием.
Обычно используется «карбеновая» номенклатура как более ясная, простая и последовательная. Выше указано, что название «карбен» является синонимом термина «метилен». Для того чтобы указать, о каком спиновом состоянии карбена идет речь, предложено всем карбенам в триплетном состоянии давать традиционные названия как производным метилена, а наименование карбен оставить для молекул в синглетном состоянии. Кроме того, предложено применять эту номенклатуру к основному состоянию молекул.
Хотя для некоторых карбенов установлены различные формы, в которых они существуют в основном состоянии, однако в отношении других карбенов это не всегда справедливо. Более того, карбены часто реагируют в возбужденных состояниях, которые по форме могут быть как сходны, так и отличны от основного состояния. По этой причине промежуточно образующиеся нестойкие частицы с «двухвалентным» углеродом обычно называются «карбенами», а их спиновое состояние, если оно известно, обозначается определениями «синглетный» или «триплетный».
Исторический обзор
Первые попытки получить метилен были предприняты в то время, когда не было еще установлено, что углерод четырехвалентен. С этой целью Дюма и Реньоль пытались дегидратировать метиловый спирт, действуя на него пятиокисью фосфора или концентрированной серной кислотой. Перро изучал пиролиз хлористого метила, ставя целью отщепление от него хлористого водорода. Бутлеров обрабатывал в запаянных трубках йодистый метилен порошком меди, но получил лишь этилен.
Второй период изучения карбенов начался с открытия изо- иитрилов и производных гремучей кислоты. Неф, основываясь на собственных исследованиях, предложил «общую теорию метилена», согласно которой большинство реакций замещения осуществляется в результате последовательных а-элиминирования и присоединения. Лишь немногие химики, современники Нефа, разделяли эти взгляды. Неф считал, что «метилен станет доступным в недалеком будущем». Вероятно, он все еще думал, что метилен, если его удастся получить, окажется устойчивым соединением.
Химия гетероциклических карбенов долгое время ограничивалась преобразованиями, в которых карбены генерировались in situ, причем в этих случаях не всегда можно доказать их действительное образования. С открытием Г. Бертраном и А. Ардуенго в 1988-1991 годах первых стабильных карбенов начался новый этап развития химии соединений двухвалентного углерода. На сегодняшний день известно около двух сотен стабильных карбенов, свойства которых интенсивно изучаются. Исследование направлений преобразований этих соединений с органическими субстратами перспективные в плане развития методов органического синтеза.
Отличительная особенность карбенов
Уникальность карбенов как фундаментальных химических частиц среди других, в частности карбанионов, карбокатионов, органических радикалов заключается в том, что в них сочетаются свойства как карбанионов (нуклеофильность), так и карбокатионов (електрофильнисть). Они способны выступать амбифильными реагентами, где амбифильность сосредоточена на одном (карбеновом) атоме.
Кроме того, при определенных обстоятельствах карбены могут проявлять и свойства бирадикалив (триплетные карбены конечно электрофильные), парамагнитные свойства которых касаются преимущественно одного карбенового атома. Карбены образуются обычно как синглетные частицы, но синглетное состояние не обязательно является основным (оно в основном характерно для гетерозамещенных карбенов, в частности гетероциклических). Важной характеристикой карбенов является величина энергетического зазора между синглетным и триплетным состояниями, чем в значительной степени определяется направление реакции карбенов как синглетной или триплетной частицы.
Амбифильнисть определяет особенности химического поведения карбенов, предоставляя своеобразия течения классических реакций с их участием и формированию конечных продуктов превращений. При данных условиях в зависимости от структуры на первом этапе преобразования превалирует нуклеофильный или электрофильный характер карбена, или карбеновые взаимодействия с $\pi$-связью / $\pi$ -системой может происходить и синхронно как циклоприсоединения. Следует отметить, что многие формально карбеновые реакции могут быть интерпретированы как такие, протекающих не из кинетически независимыми частями карбенов, а с их координационным комплексом с растворителем или с карбеноидным прекурсором - прекарбеном (precarbene) (например, гетероареновой солью или диазосоединениями).












