
Стабилизация органических ионов
Высокая химическая активность карбанионов прежде всего связана с электростатическими взаимодействиями. Точечный заряд, сосредоточенный на одном атоме углерода, может создавать электрическое поле, которое оказывает воздействие на все ближайшее окружение этого заряда.
Воздействие ионного заряда на неионные молекулы повышает поляризацию их связей, а также создает предпосылки для полной ионизации. Эти процессы объясняют высокую реакционную способность органических ионов, которые
- сильно ограничивают выбор растворителей, инертных по отношению к данным ионам;
- сужают выбор функциональных групп субстратов, которые могли бы такое воздействие выдержать.
Катион ацетилия было бы невозможно удержать в спиртовом растворе или применить для ацетилирования бензилового спирта в ядро из -- за мгновенно протекающих реакций:
$CH_3CO^+SbCl_{6^-} + C_2H_5OH → CH_3COOC_2H_5 + HSbCl_6;$
$CH_3CO^+SbCl_{6^-} + C_6H_{5^-}CH_2OH → C_6H_{5^-}CH_2OCOCH_3 + HSbCl_6.$
Поляризация связей происходит не только в молекулах, окружающих ион, но и в самих органических ионах.
Относительно устойчивый ион третбутилкатион в присутствии даже слабых оснований теряет протон с образованием изобутилена, то есть происходит элиминирование. Пара электронов, участвующих в образовании $CH$-связи полностью переходят к положительному заряду с образованием двойной связи. В результате происходит полная диссоциация поляризованной $CH$-связи и выброс протона, уносящего заряд.
Для уменьшения реакционной способности органических ионов необходимо ослабить их электростатическое взаимодействие с другими молекулами.
Для этого необходимо перевести заряд из точечного в «размазанный», что достигается введением дополнительных групп в ион, способствующие перераспределению заряда между несколькими атомами. При этом полный заряд иона сохраняется, но возрастает его эффективный радиус. «Размазывание» заряда становится возможным благодаря поляризации связей.
Стабилизация карбанионов должна обеспечиваться электроноакцепторными группами, то есть группами, способными оттягивать электроны от анионного центра.
Еноляты -- стабильные карбанионы
Еноляты являются классическим примером стабильных карбанионов. Они образуются из карбонильных соединений при действии сильных оснований. Заряд может находиться и на углероде, и на кислороде.
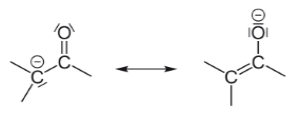
Рисунок 1.
Но наиболее точно структуру таких карбанионов отображает формула
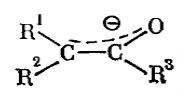
Рисунок 2.
В схеме штрихи и символ заряда показывают, что электронная пара распределена между тремя атомами, а заряд -- между двумя крайними атомами системы.
Другие способы стабилизации карбанионов
По сходному с енолятами принципу происходит стабилизация
- карбанионов другими электроноакцепторными группами, содержащими кратные связи, во фрагментах типа ($-C-COOR,$ $-C-C\equiv N$, $-C(COOR)_2$ и др);
- карбанионов, содержащих у анионного центра многоэлектронные легко поляризуемые гетероатомы серы или селена.
Вклады нескольких поляризуемых групп в делокализацию заряда суммируются.
Эффективная стабилизация при высокой реакционной способности возможна в биполярных ионах, особенно, если атомы или группы атомов, несущих заряды противоположного знака, соседствуют в их структуре.
Илиды - биполярные ионы, в которых карбанионный центр стабилизирован соседним положительным центром на атомах серы, фосфора, мышьяка и др.
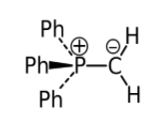
Рисунок 3.
Существуют внешние причины, способствующие стабилизации карбанионов, связанные с факторами внешней среды, в которой находятся активные частицы.
-
Наиболее важной является природа противоиона. Если противоион обладает низкой реакционной способностью и высокой делокализацией заряда, то это будет затруднять его ассоциацию с карбанионом с образованием ковалентной связи и повышает стабильность системы.
Для карбанионов хорошими противоионами являются малореакционноспособные катионы щелочных металлов. Особенно, если они связаны в комплексы с циклическими лигандами типа краун -- эфиров. А также органические ионы с сильно экранированным центром заряда типа тетра-н-бутиламмония:
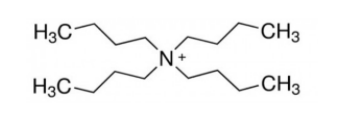
Рисунок 4. -
Природа растворителя. Влияние растворителя можно свести к двум основным составляющим:
-
Полярный растворитель обладает высокой диэлектрической постоянной, в результате чего снижается электростатическое взаимодействие зарядов.
-
Нековалентные взаимодействия молекул растворителя с положительными и отрицательными ионами (образование водородных связей, заряд -- дипольное взаимодействие и другие взаимодействия сольватации) приводят к существенному экранированию центров заряда молекулами растворителя, делокализации заряда, а также его распределению между ионом и сольватной оболочкой.
Любой способ стабилизации карбанионов путем делокализации заряда тем эффективнее, чем значительнее смещение электронов от анионного центра. Однако при такой делокализации не должен происходить разрыв старых и образование новых ковалентных связей.
Атомы хлора могут эффективно оттягивать электроны, поэтому, можно предположитьь, что они хорошо стабилизируют карбанионные центры. Тогда можно предположить, что трихлорметильный анион является высокостабильным карбанионом. Однако он легко выбрасывает анион хлора и образует дихлоркарбен. Такое элиминирование и протекает хорошо потому, что хлор «слишком хорошо» связывает электроны и дает стабильный хлорид-ион.
Типичные карбанионы даже при существенной делокализации заряда сохраняют высокую реакционную способность. И этого следует, что
- карбанионы способны эффективно взаимодействовать с положительным полюсом диполя поляризованных ковалентных молекул.
- многие соединения в которых содержится сильно поляризованная ковалентная связь, по распределению зарядов приближающаяся к ионной, проявляют высокую реакционную способность, близкую к соответствующим ионным системам. \end{enumerate}











