Специфический кислотный катализ
Если молекулы реагентов содержат атомы электроотрицательных элементов, то перенос протона осуществляется очень быстро. В результате, в реакциях прежде всего устанавливается равновесие между реагентом и его сопряженной кислотой. Далее в лимитирующей скорость стадии сопряженная кислота образует продукт реакции Р.
Если раствор водный, справедливо соотношение
Применяя принцип стационарных концентраций, получаем выражение для скорости
Протон, взятый на первой стадии, во второй стадии возвращается в среду, поэтому концентрация $[H_3O^+]$ остается постоянной. Следовательно, гидроксоний можно не учитывать в выражении для скорости.
В результате получаем уравнение реакции псевдопервого порядка, не учитывающее концентрацию катализатора $[H_3O^+]:$
Катализ обнаруживается при анализе кинетики при разных $pH$. Константа скорости реакции псевдопервого прядка увеличивается пропорционально повышению концентрации гидроксония.
Специфический кислотный катализ протекает, если скорость реакции пропорциональна только концентрации гидратированного протона или обратно пропорциональна его $pH$.
Если среда -- неводная, то катализаторами выступают молекулы протонированного растворителя: $CH_3COO{H_2}^+$ в уксусной кислоте, $N{H_4}^+$ в жидком аммиаке, $H_3S{O_4}^+$ в серной кислоте и др.
Ион лиония -- это кислота, сопряженная нейтральной молекуле растворителя. Отсюда следует, что специфический кислотный катализ -- это катализ ионами лиония.
Специфический основной катализ
Специфический основной катализ определяется тем, что скорость реакции пропорциональна только концентрации гидроксильных ионов $[OH^-]$ или $pH$.
Реакция специфического основного катализа начинается с отрывва протона от реагента гидроксильным ионом:
Лиатный ион -- это основание, сопряженное нейтральной молекуле протонного растворителя. Специфический основной катализ -- это катализ лиатным ионом.
Димсиланионин $CH_3SOCH_2$ в ДМСО, $CH_3O^-$ в $CH_3OH$ и др.
Сравнение специфического кислотного и основного катализа
Специфический кислотный и основной катализ мы сравним на примере гидролиза сложных эфиров.
-
Гидролиз эфиров при специфическом кислотном катализе. Катализатором служат ионы гидроксония и выражение скорости этой реакции имеет вид:
\[w=K_{H^+}\left[H_3O^+\right]\left[S\right],\]где $\left[S\right]$ --концентрация субстрата (сложного эфира).
Механизм протекания гидролиза сложных эфиров сводится к следующим этапам:
-
от иона $H_3O^+$ отщепляется протон и переходит к атому кислорода, принадлежащего спирту;
-
в результате нуклеофильной атаки молекулы воды на карбонильный атом появляется промежуточное вещество ионного типа;
-
промежуточное вещество распадается с образованием спирта и положительно заряженной кислоты;
-
заряженная кислота передает протон молекуле воды
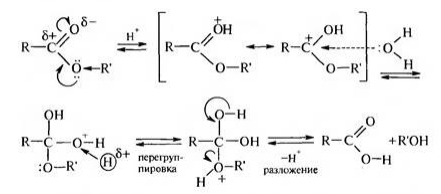
Рисунок 1. -
-
Гидролиз эфиров при специфическом основном катализе. Скорость реакции прямо пропорциональна концентрации гидроксильных ионов:
\[w=K_{{OH}^-}\left[{OH}^-\right]\left[S\right],\]-
нуклеофильная атака иона гидроксила на карбонильный углерод;
-
электрофильная атака молекулы воды на атом кислорода спиртовой группы, при этом переносится протон.
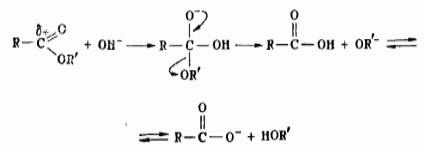
Рисунок 2.И при кислотном, и при щелочном гидролизе происходит нуклеофильная атака на карбонильный атом углерода, сопровождающаяся передачейпротона атому кислорода спиртовой группы. Подтверждением этому служит влияние электроноакцепторных заместителей в кислотной группе эфира.
-
Если в кислотную группу эфира ввести нитрогруппу, скорость гидролиза увеличится, так как заместитель будет облегчать атаку нуклеофильного реагента на карбонильный атом углерода.
Влияние заместителя больше проявляется при основном катализе, когда нуклеофильная атака осуществляется ионом гидроксила, а не молекулой воды, как при кислотном гидролизе. То есть электрофильные заместители сильнее влияют на скорость щелочного гидролиза.
При специфическом кислотном катализе в промежуточных стадиях происходит присоединение и отщепление протона, при специфическом основном катализе -- присоединение гидроксила, а также его образование в результате передачи протона от воды к субстрату. Обе реакции являются кислотно -- основными.
Отличие основного катализа состоит в механизме реакции: активный промежуточный продукт образуется при отрыве протона от субстрата, а не при внедрении, как при кислотном катализе. Иногда промежуточный продукт появляется при внедрении гидроксила в реагирующую группу субстрата.
Реакцию относят к специфическому кислотному или основному катализу не на основании подробного механизма процесса, а на основании вида кинетического уравнения.
Механизм специфического кислотного катализа наблюдается при
-
гидролизе ацеталей;
-
реакции инверсии сахарозы;
-
гидратации ненасыщенных альдегидов и др.
Механизм специфического основного катализа наблюдается при
-
гидратации альдегидов;
-
альдольной конденсации;
-
гидролизе сложных эфиров и др.


















