Константы кислотности и основности
Константа равновесия является количественной характеристикой силы кислоты или основания. Количественно кислотность вычисляют по отношению к воде. При этом мерой кислотности выступает константа равновесия реакции (константа кислотности) $Ka$. Для выражения $A ↔ B + H^+$ константа кислотности равна:
Стандартное равновесие имеет вид: $H_3O^+ ↔ H_2O + H^+$, $Ka = 1$. Тогда для любого кислотно -- основного процесса:
$A_1 + B_2 ↔ A_2 + B_1$
При взаимодействии с водой любой кислоты $A$ константы равновесия соответствуют приведенным в справочной литературе значениям:
$A + H_2O ↔ H_3O^+ + B^-$
-
для многоосновных кислот, последовательно отдающих несколько протонов, первая константа кислотности всегда выше последующих;
-
для оксокислот (группы $-OH$ присоединены к одному и тому же атому) $pK_{a2}$ обычно больше $pK_{a1}$ на $5$.
Значения $pK_{ai}$ для ортофосфорной кислоты равны $2,12$; $7,21$; $12,67$ для $i = 1,2,3$ соответственно. То есть в водной среде преобладают разные кислотно -- основные равновесия в зависимости от $pH.$
На рис. 1 отображено содержание разных ионов ортофосфорной кислоты как функция $pH$, $x_i$ - доля данного иона в смеси.
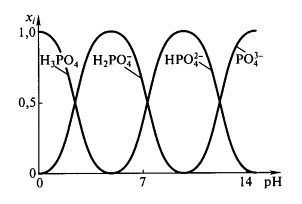
Рисунок 1. Зависимость относительного содержания различных ионов ортофосфорной кислоты от $pH$
При небольших значениях $pH$ доля иона ${PO}^{3-}_4$ очень мала, но при $pH > pKa1$ этот ион начинает доминировать. Протонированные ионы, в основном, присутствуют в растворе, когда $pH$ имеет промежуточное между соответствующими $pKa$ значение.
Константа основности рассчитывается исходя из соотношения:
$B + H_2O ↔ A +OH^-$
Константу кислотности можно связать с константой основности соотношением:
$pKa + pKb = 14.$
Чем сильнее будет сопряженная кислота, тем слабее сопряженное основание. Величине рКa соответствует значение --$lgKa.$
Кислота считается сильной, если $pKa
$HA + H_2O = +A^-$ будут идти практически до конца и кислотные свойства определяются исключительно свойствами $H_3O^+.$
Основание является в водном растворе сильным, если $pKb
Значения $pKa$ для слабых кислот лежат в интервале $\sim 2-15,7$.
Автопротолиз воды
Равновесие автопротолиза воды имеет вид:
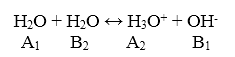
Рисунок 2.
Для данной реакции термодинамическая константа равновесия установлена экспериментально. При температуре $298 \ K$ она равна:
$K = [H_3O^+][OH^-] = 1 \cdot 10^{-14}$
Данную константу равновесия называют ионным произведением воды $Kw.$
Согласно протолитической теории, константа равновесия реакции автопротолиза равна константе кислотности воды $Ka (H_2O).$ Исходя из величины $Kw$, определяется шкала $pH$:
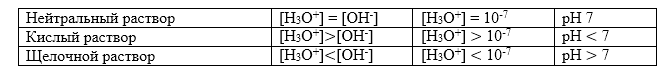
Рисунок 3.
Гидролиз
Согласно теории Бренстеда -- Лоури, гидролиз солей можно рассматривать как частный случай кислотно -- основного равновесия. Гидролиз -- обменное взаимодействие ионов с водой, протекающее с изменением $pH$.
Гидролиз по аниону представлен уравнением:
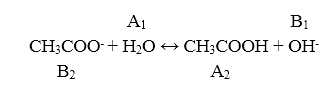
Рисунок 4.
Константа гидролиза $Kr$ является константой основности сопряженного основания $CH_3COO^-.$
Гидролиз по каниону представлен уравнением:
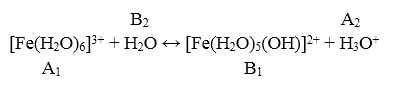
Рисунок 5.
В данном примере константа гидролиза является константой кислотности сопряженной кислоты $[Fe(H_2O)_6]^{3+}.$
Чем сильнее гидролиз по аниону, тем слабее кислота. Чем сильнее гидролиз по катиону, тем слабее основание.Равновесие гидролиза практически всегда смещено влево, при $Kr ≪ 1$. Наличие гидролиза можно определить по изменению $pH$ раствора.
Гидролиз усиливается при:
- нагревании;
- разбавлении;
- добавлении веществ, связывающих ионы $OH^-$ или $H_3O^+.$












