
Функция кислотности Гаммета
В разбавленных водных растворах кислотность выражается значением $pH$. Очень слабые кислоты могут ионизироваться в ощутимой степени только в концентрированных растворах оснований, а слабые основания способны протонироваться в концентрированных растворах кислот.
Гаммет и Дейрап ($1932$г.) предложили использовать для концентрированных растворов кислот функцию кислотности $H_0$. Нулевая функция показывает меру «стремления» протона кислоты перейти к нейтральной молекуле основания.
Чем больше функция кислотности, тем более протонизировано основание $B$. Величина $H_0$ характеризует протонодонорную активность среды.
Функцию кислотности можно представить выражением:
где $\frac{[B]}{[{BH}^+]}$ -- степень ионизации основания или индикаторное отношение ($I$).
Сравнивать разные кислоты по силе кислотности и наблюдать, как она может изменяться при различных концентрациях в растворителе можно, если знать величину ${pK}^B_a$ для выбранного основания и определив степень диссоциации основания в заданных условиях (температура, концентрация).
Рассмотрим изменение кислотности серной и фтористоводородной кислот в зависимости от их концентрации в воде. При одинаковых концентрациях функция кислотности Гаммета серной кислоты выше значений для фтористоводородной кислоты. В реакциях, которые связаны с перемещением протона, образованием карбоний -- ионов, проявляется большая активность серной кислоты, ее высокая кислотность.
Серная кислота обладает меньшей избирательностью, чем фтористоводородная в реакции алкилироания. Она способна ускорять реакции гидрополимеризации, скелетной изомеризации, миграции метильных групп и другие, протекающие с перемещением протона.
В случае с фтористоводородной кислотой вышеперечисленные реакции будут протекать в заметно меньшей степени, что обусловленно пониженной кислотностью.
В разбавленных водных растворах кислотность будет совпадать с концентрацией ионов водорода, а $H_0$ с $pH$.
Суперкислые среды
Если кислотная функция $H_0$ имеет высокое отрицательное значение, то рассматриваемая кислотная среда обладает сильной протонодонорной способностью.
Среда называется суперкислой, если протонодонорная сила кислотной среды равна или превышает протонодонорную силу $100\%$ серной кислоты.
Суперкислые среды используют для спектрального исследования и генерации частиц, которые имеют повышенное расположение к нуклеофильным реакциям.
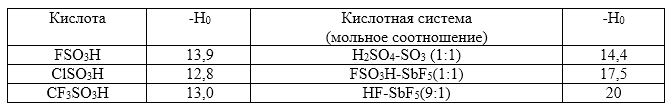
Рисунок 1. Примеры суперкислых сред
Другие функции кислотности
В своих экспериментах Гаммет использовал индикаторы, в качестве которых брал различные пары слабо основных анилинов. Однако в качестве индикаторов можно использовать и другие вещества:
-
Если в качестве индикаторов использовать амиды, то выводится функция $H_A$. Тогда $pKa(BH^+)= H_A-lgI$. Численно $H_A$ всегда меньше $H_0$, что связано с различием в гидратации катионов. Амиду в концентрированной кислоте образовать катион труднее, чем анилину, так как амидные катионы гидратированы сильнее, чем ионы анилиния. Амиды протонируются по кислороду.
-
Функция $H_{R^+}$ определяется из равновесия ионизации спиртов в концентрированной серной кислоте:
\[ROH + H^+ ↔ R^+ + H_2O\]Чаще всего $R$ -- триарилметильная группа $Ar_3C.$
\[H_{R^+}=lg\frac{a_{H_2O}{\gamma }_{R^+}}{a_{{SH}^+}{\gamma }_{ROH}}={pK}_{R^+}-lg\frac{\left[R^+\right]}{\left[ROH\right]},\]где ${pK}_{R^+}$ - константа равновесия обратной реакции R+ водой.
Константа равновесия обратной реакции является количественным показателем относительной стабильности карбокатионов $R^+$ в сильно кислых средах. Вода является продуктом данной реакции, поэтому функция $H_{R^+}$ имеет резкий подъем при сильно концентрированной кислоте.
-
В настоящее время существует множество функций кислотности для оснований различного типа: $H``` - N,N$-диалкиламидов, $H_I$ - алкилиндолов в серной кислоте, для концентрированных растворов $HClO_4$, $FSO_3H$, $HF$ и др.
Функция $Н\_$ для сильно основных сред
В функции $H_0$ индекс «ноль» указывает на то, что функция уравнивает протонирование электрически нейтральных оснований анилинов. В случае, когда основания имеют отрицательный заряд, существует функция, описывающая их протонирование - $H\_.$
Анионов, которые существовали бы в концентрированных растворах кислот немного. Это, например, полицианированные сопряженные карбанионы: пентацианаллильный анион ($pKa=-8,5$), пентациклопентадиенильный анион ($pKa
Большинство органических анионов являются сильными основаниями, поэтому протонированы даже в разбавленной кислоте.
Для определения меры основности сильно основных сред используют протонизацию очень сильных оснований (отщепление протона от очень слабых кислот). Сильными основными средами являются концентрированные водные растворы щелочей, сильно разбавленные растворы ($0,001M$) гидроксида тетраметиламмония ($CH_3)_4N^+OH^-$ - в смесях ДМСО с водой.
В роли индикаторных оснований выступают нитроанилины или нитродифениламины, находящиеся в равновесии с их анионами.
В разбавленных водных растворах $Н\_ = pH$.
Шкала $H\_$ строится путем попарного сравнения индикаторов с использованием соотношения:
Функция $H\_$ помогла определить значения $pKa$ для многих слабых $NH^-$, $CH^-$, $OH^-$ кислот.
$CH^-$ кислотность играет важную роль в органическом синтезе, так как позволяет количественно оценивать относительную стабильность карбанионов -- важных интермедиатов.
К сильно основным средам относят:
-
циклогексиламид щелочного металла (гидразид);
-
жидкий аммиак;
-
растворы трет-бутилата калия в ДМСО;
-
димсилнатрий (натриевая соль диметилсульфоксида, полученная при растворении гидрида натрия в ДМСО):











