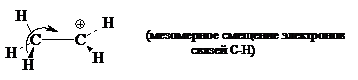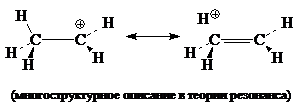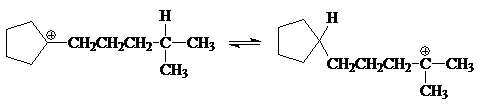Среди алкильных катионов наименее стабильным катионом является $CH_{3^+}$, а наиболее стабильными являются третичные катионы с общей формулой $R_3C^+$. Закономерность изменения стабильности в ряду первичные индуктивными эффектами алкильных групп. Гиперконъюгации метальных групп обусловлены взаимодействиями этих групп с вакантными $p$-орбиталями карбокатионных центров. Так, для этильного катиона возможно изобразить следующую альтернативную схему, описывающую гиперконъюгацию:
Порядок устойчивости простых алкильных катионов можно также объяснить ($+I$)-эффектом алкильных групп, который понижает концентрацию заряда на карбокатионном центре (как правило, заряженная частица тем устойчивее, чем меньше концентрация заряда).
Для такого взаимодействия необходимо, чтобы вакантная орбиталь катиона была $p$-орбиталью. Отсюда следует, что алкильные катионы должны иметь плоскую тригональную структуру. Квантово-химические расчеты, а также ИК- и ЯМР-спектры показывают, что плоская конфигурация алкильных катионов действительно самая выгодная. Согласно расчетам, плоская конфигурация предпочтительна даже для метильного катиона, в котором гиперконъюгация невозможна. Объяснение состоит в том, что шесть валентных электронов плоского катиона $CH_{3^+}$ расположены на трех $sp2$-гибридных орбиталях атома углерода, и поэтому ближе к ядру, чем в пирамидальном катионе $CH_{3^+}$ где они расположены на приблизительно $sp3$-гибридных орбиталях, поскольку s-характер у $sp2$-орбитали больше, чем у $sp3$.
Порядок устойчивости простых алкильных катионов можно также объяснить ($+I$)-эффектом алкильных групп, который понижает концентрацию заряда на карбокатионном центре (как правило, заряженная частица тем устойчивее, чем меньше концентрация заряда).
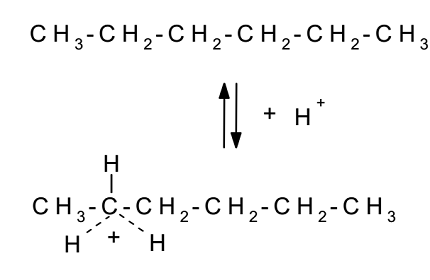
Циклоалкильные катионы, содержащие 5-, 7- или 8-членные циклы, стабильнее соответствующих ациклических аналогов. Этим, в частности, объясняется тот факт, что равновесие
Классический механизм Б.С. Гронсфельда
Производительность попыток Р.С. Хэнсфорд и С. Томаса объяснить крекинг алкенов на основе теории ионных реакций стала очевидной сразу, и уже в 1949 Б.С. Гринсфельдер с сотрудниками предложил классический цепной механизм, согласно которому первой стадией реакции является протонирования олефинов по ненасыщенным связям с образованием алкильных карбокатионов:
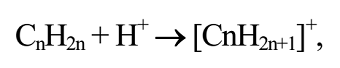
существование которых вскоре было доказано экспериментально. Образование карбокатионов возможно также через отрыв гидрид-иона от парафиновой молекулы:
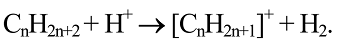
Согласно классической теории, карбокатионы ионизируют молекулы парафина по механизму цепной реакции:

Разложение карбокатионов, по С. Томасу и Б.С. Гринсфельдеру, идет ступенчато через разрыв связи $C-C$ в $\beta$-положении по отношению к положительно заряженному атому углерода ($\beta$-распад).
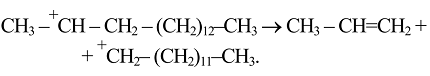
Возникающие первичные карбокатионы подвержены изомеризации с образованием более устойчивых вторичных, а в дальнейшем - третичных. Последнее являются продуктами скелетной изомеризации:
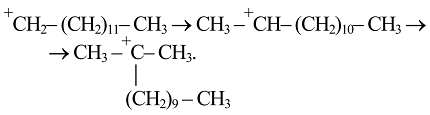
Значительное преобладание разветвленных углеводородов в продуктах каталитического крекинга по сравнению с продуктами термического является одной из характерных черт первого.
Современный механизм на основе представлений Дж. Ола
Настоящим прорывом в теории органических реакций и реакционной способности стали подходы Дж. Ола начале 1970-х годов, они основываются на представлении о суперкислотнисти, когда сила кислотных центров по шкале Гаммета на 8-10 порядков превосходит силу концентрированной серной кислоты. Суперкислоты, по Дж. Ола, способны протонировать насыщенные молекулы, в том числе парафиновые углеводороды, к структурам с пента- координированным атомом углерода назваными карбониевыми ионами,
которые в дальнейшем, из-за потери двух водородных атомов, могут переходить к классическим карбен-ионным структурам
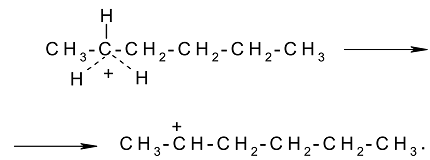
Данные стадии являются именно теми стадиями, которых не хватало классической теории крекинга.
Суперкислотная теория Ола, созданная в рамкох органической химии, не сразу вошла в теорию крекинга углеводородов. До 1984 г. она сравнительно редко упоминалась в этой связи. Понятие суперкислотности для системы, например $SbF_{5^-}HF$, а не ассоциировалост с кислотностью не только алюмосиликатов, но и цеолитов, которые по силе кислотных центров находятся на уровне $H_2SO_4$ и $HF$: не учитывался очень существенный (на много порядков) рост силы кислотных центров аморфных алюмосиликатов и цеолитов за счет повышенной температуры. Одним из первых, кто очень близко подошел к осознанию значимости теории Ола для крекинга, был С.Н. Хаджиев.
Следующим очень серьезным шагом в развитии суперкислотной теории крекинга был механизм крекинга алканов В. Гаага и Р. Дессау. Механизм возник на основе анализа распределения продуктов крекинга 3-метилпентана и н-гексану на твердых кислотах при $350-550^\circ C$ в широком диапазоне конверсий. По В. Гаагу и Р. Дессау, карбокатионы подлежат не $\beta^-$, а $\alpha$-распаду:
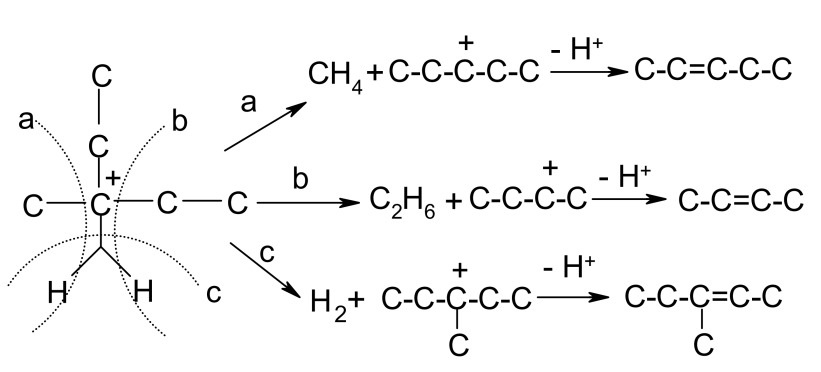
Совсем недавно стали известны экспериментальные факты (и это уже создает затруднения же для классической, так и современной теории крекинга), согласно которым на твердых кислотных или даже суперкислотных катализаторах обмену на дейтерий подвергается водород только первичных углеродных атомов изобутана. Так же при контакте полностью дейтерированного изобутана с водородными формами цеолитов дейтериообмен между цеолитом и катализатором происходит только за счет дейтерия первичных углеродных атомов.
Несмотря на недостатки, классический механизм не теряет актуальности потому что суперкислотный механизм демонстрирует адекватность только для крекинга чистых парафинов. В случае смесей парафинов с олефинами протонирование идет, естественно, гораздо легче. То есть классический механизм продолжает сосуществовать с современным.
Вполне закономерно, что реакция крекинга продолжает интенсивно изучаться с использованием тех или иных индивидуальных углеводородов.