
Первые $\pi$-комплексы получил Г. Браун в $1952$. Он пропускал сухие газообразные галогенводороды, в частности $HCl$ ( а затем и $DCl$) через бензо, в н-гептане при $–78^\circ C.$ В результате чего он обнаружил молекулярный комплекс состава $1:1$. Такой донорно-акцепторный комплекс получил название $\pi$ -комплекса. Толуол, ксилолы или другие полиалкилбензолы в аналогичных реакциях также давали $\pi$ -комплексы.
Образование $\pi$- комплексов
Как уже говорилось, для бензола характерно образование некоторой электронной плотности вне плоской молекулы. Можно ожидать, что такая электронная плотность будет легко поддаваться атаке электрофилом. Тогда на первой стадии атаки будет иметь место взаимодействие между соответствующим электрофилом и делокализованными $\pi$-орбиталями ароматической системы с образованием так называемого π-комплекса. Так, толуол образует при охлаждении до $-78^\circ C$ комплекс с хлористым водородом в мольном соотношении $1:1$, причем реакция обратная. Тот факт, что в данном случае не происходит образования связи между атомом углерода и протоном хлористого водорода подтверждается данными по реакции с $DCl$. Связь $C-D$ не образуется. Ароматические соединения образуют π-комплексы не только с галогенами, а и с ионами металлов например $Ag^+$ , а также с органическими ионами. Так комплексы с пикриновой кислотой устойчивые кристаллические соединения.
Свойства $\pi$-комплексов
$\pi$-Комплексы не являются классическими химическими соединениями, в которых электрофильный реагент связан с каким-то конкретным атомом углерода. Большинство $\pi$-комплексов легко разлагаются при нагревании или при воздействии воды. Их растворы проводят ток. Чем большей π-электронной плотностью обладает соединение, тем легче образуются $\pi$-комплекс.
Устойчивость $\pi$-комплексов очень слабо зависит от природы ароматических субстратов:
- устойчивость $\pi$-комплексов $HCl$ и $DCl$ при $-78^\circ C$ при переходе от бензола к $1,3,5$-триметилбензолу и $1,2,4,5$-тетраметилбензолу возрастает всего в $3-4$ раза
- устойчивость $\pi$-комплексов йода с бензолом и гексаметилбензолом различаюется не более чем в десять раз.
Строение $\pi$-комплексов
$\pi$-Комплекс алюминия с бензолом построен объемно. Атом алюминия, который имеет некоторый дефицит электронной плотности пытается достроить электронную оболочку до октета при взаимодействии со всей электронным облаком бензола. Атом алюминия находится на одинаковом расстоянии от всех атомов углерода. Если дипольный момент бензола равен нулю, а бромистого алюминия всего $0,1D$, то окрашенный в желтый цвет $\pi$-комплекс имеет дипольный момент $5,0D$. Это может служить доказательством смещения $\pi$-электронного облака бензола в направлении атома алюминия и накопления электронной плотности на атомах брома.
Подробно изучены стабильные $\pi$-комплексы бензола с тетрацианетиленом, который является електроноакцепторным реагентом из-за смещения электронной плотности на атоме азота.
Бензол, как и другие арены, обладает основными свойствами, и он способен образовывать донорно-акцепторный комплекс с кислотами Льюиса и с недиссоциированными молекулами $DCl$ или $HCl$, а также с другими электрофильными агентами. Так комплекс бензола с бромом с составом $1:1$ имеет кристаллическую структуру, и согласно данным рентгеноструктурного анализа, состоит из цепочки чередующихся молекул $Br_2$ ($\pi$ -донора), в которой молекулы галогена расположены перпендикулярно плоскости ароматического кольца.
Существуют и иные ориентации акцепторов относительно ароматических систем. Так, в комплексах бензола с различными солями серебра с составом $1:1$ катионы серебра координируются с двумя ароматическими кольцами, располагаясь над и под $C(1) - C(2)$ и $C(4) - C(5)$ углерод-углеродными связями:
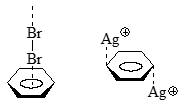
Рисунок 1.











