Известно, что для определения $MO$ и соответствующих значений энергии по методу молекулярных орбиталей ($MMO$), необходимо решать вековое уравнение:
$\left|H_{\mu \, v} -ES_{\mu \, v} \right|=0$ (1)
Согласно этому методу, волновая функция, т.е.молекулярная орбиталь
($MO$) ищется в виде линейной комбинации атомных орбиталей-ЛКАО:
$\psi =\sum \limits _{\mu } c_{\mu } \varphi _{\mu } $ (2)
$\varphi _{\mu } $- $AO$, $\psi $ - $MO$.
Хюккель предложил простую форму метода молекулярных орбиталей ($MMO$), которая дала возможность значительно упростить детерминант (1). Сущность этого упрощения заключается в том, что $\pi $ и $\sigma $ -связи разделяются и рассматриваются только $\pi $ -связи. Сделано 2 допущения:
-
Все $\pi $ -орбитали имеют одну узловую плоскость.
-
Длина всех связей одинакова. Рассматриваются только соседние атомы, т.е. пренебрегается всеми несоседними взаимодействиями.
Принятые упрощения можно считать справедливыми только для ненасыщенных углеводородов. Рассматривается линейная комбинация $2p_{z} $ $AO$ атома углерода, образующих нелокализованные $\pi $- связи. Атомы водорода в этом методе не рассматриваются.
Приближения в методе Хюккеля
Метод Хюккеля допускает следующие приближения:
-
Интегралы перекрывания для $AO$, относящихся к соседним атомам, считаются равными нулю:
\[S_{\mu \, v} =\left\{\begin{array}{l} {1\, \, \, \mu =v} \\ {0\, \, \, \mu \ne v} \end{array}\right. \, \, \, \, \, S_{\mu \, v} =\int \varphi _{\mu } \varphi _{v} dV \] -
Интегралы $H_{\mu \, v} $ полагаются одинаковыми для всех атомов. Их обозначают буквой $\alpha $ и называют кулоновским интегралом:
\[\, \, \, \, H_{\mu \, \mu } =\int \varphi _{\mu } \hat{H}\varphi _{\mu } dV =\alpha ,\, \, \, \, \, \alpha \, Эти интегралы характеризуют энергию электронов $2p_{z} $ $AO$ углерода.Значение $\alpha $ обычно принимается равным потенциалу ионизации атомов углерода (с обратным знаком) в $2p$ валентном состоянии.
-
Интегралы $H_{\mu \, v} $ принимаются одинаковыми для всех пар, непосредственно связанных между собой, с номерами $\mu $ и $v$ (т.е. соседние атомы: $\mu \to v$).
Их обозначают буквой $\beta $ и наз. резонансным интегралом:
\[\, \, \, \, H_{\mu \nu \, } =\int \varphi _{\mu } \hat{H}\varphi _{\nu } dV =\beta ,\, \, \, \, \beta \, Резонансный интеграл -- это отрицательная величина, равная энергии заряда, распределенного с плотностью $\varphi _{\mu } \varphi _{v} $ в поле ядер, экранированных $\sigma $-электронами. Резонансный интеграл характеризует энергию взаимодействия между двумя атомными орбиталями. -
Интеграл $\, \, \, \, H_{\mu \, v} =0$ для всех атомов, непосредственно не связанных между собой. Величинами $\alpha $ и $\beta $ пользуются как параметрами при расчетах. При этих предположениях уравнение:
\[\sum \limits _{v} \left(H_{\mu \, v} -ES_{\mu \, v} \right)\, c_{v} =0\]может быть записано:
$\left. \begin{array}{l} {c_{1} \left(\alpha -E\right)+c_{2} \beta _{12} +...+c_{n} \beta _{1n} =0} \\ {c_{1} \beta _{21} +c_{2} \left(\alpha -E\right)+...+c_{n} \beta _{2n} =0} \\ {..............................................} \\ {c_{1} \beta _{n1} +c_{2} \beta _{n2} +...+c_{n} \left(\alpha -E\right)=0} \end{array}\right\}$ (4)
Эта система уравнений имеет решения, отличные от 0, если ее детерминант равен нулю, т.е.
$\left|\begin{array}{l} {} \\ {} \\ {} \\ {} \end{array}\right. \begin{array}{cccc} {\left(\alpha -E\right)} & {\beta _{12} ....} & {} & {\beta _{1n} } \\ {\beta _{21} } & {\left(\alpha -E\right)} & {} & {\beta _{2n} } \\ {......} & {.....} & {} & {.....} \\ {\beta _{n1} } & {\beta _{n2} } & {} & {\left(\alpha -E\right)} \end{array}\left. \begin{array}{l} {} \\ {} \\ {} \\ {} \end{array}\right|=0$ (5)
Систему уравнения (4) можно записать в более упрощенном виде, если ввести следующие обозначения:
$c_{\mu } \left(\alpha -E\right)+\sum \limits _{\mu \to v} c_{v} \beta =0$ (6)
$X=\frac{\alpha -E}{\beta } \, \, \, \, Xc_{\mu } +\sum \limits _{\mu \to v} c_{v} =0$ (7)
Решая уравнения, полученные при раскрытии детерминанта (5), получим $n$ значений для энергии, выше и ниже нулевого значения.
$E_{\mu } =\alpha +m_{\mu } \beta $ (8)
\[\mu =1,...,n\]За нуль энергии принимается значение величины $\alpha $, т.е. энергия электрона на $2p_{z} $ $AO$ изолированного атома углерода. Графически это изображается в следующем виде:
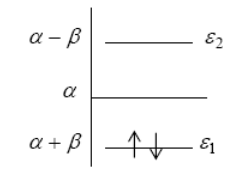
Рисунок 1.
Расчет молекулы этилена ($C_{2} H_{4} $)
Рассмотрим применение метода Хюккеля к молекуле этилена $C_{2} H_{4}$.
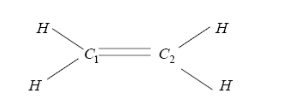
Рисунок 2.
Обозначим $\pi $ -электроны $C_{2} H_{4} $ цифрами $1$ и $2$
Согласно формуле (6) напишем систему уравнений и вычислим
детерминант:
Коэффициенты «С» определим из условия нормировки:
$c_{1}^{2} =\frac{1}{2} $; $c_{1} =\pm \sqrt{\frac{1}{2} } =\pm \frac{1}{\sqrt{2} } $ . Так как выбор знака коэффициента произволен, то принимаем $c_{1} =\frac{1}{\sqrt{2} } $
Тогда:
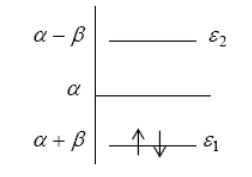
Рисунок 3.
Функция $\psi _{1} $ характеризуется более низкой энергией электрона, чем в изолированном атоме углерода ( величина $\alpha $ в приближении Хюккеля ) и поэтому она является связывающей молекулярной орбиталью;
$\psi _{2} $- разрыхляющая орбиталь, так как ей соответствует более высокая , чем в изолированном атоме , энергия электрона. Согласно принципу Паули, два
$\pi $- электрона молекулы этилена находятся на уровне E1 c противоположными
спинами. Общее значение энергии этих электронов $\, \, \, E_{\pi } =2(\alpha +\beta )$.












