Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^\circ \ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
Итак, если смесь метана с хлором нагреть до $200^\circ \ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
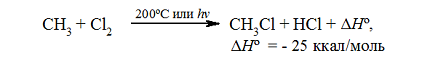
Рисунок 1. Хлорирование метана
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.
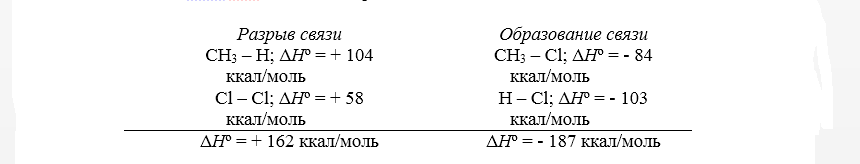
Рисунок 2. Хлорирование метана
Суммарный тепловой эффект $\Delta \underline{H}^\circ = - 25$ ккал/моль. Эти данные показывают, что хлорирование метана представляет собой вполне вероятный процесс, хотя тепловой эффект никоим образом не связан со скоростью реакции, которая определяется свободной энергией активации.
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
-
зарождение цепи (инициирование)
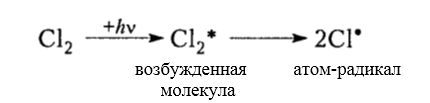
Рисунок 3. Хлорирование метана -
рост цепи
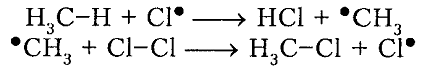
Рисунок 4. Хлорирование метана -
обрыв цепи (рекомбинация)
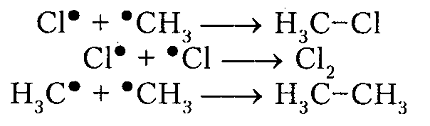
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h \nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 \ 000$ и более.
На рис. 6 показана энергетическая диаграмма хлорирования метана.
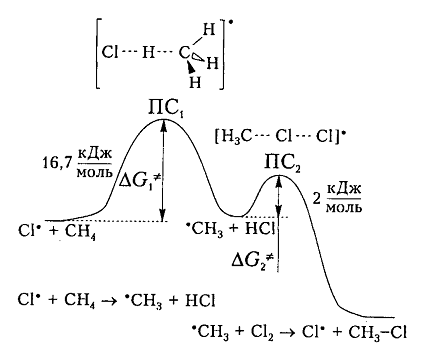
Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи - связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой ${\rm H}-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах - плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
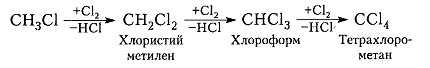
Рисунок 7. Хлорирование метана
Ионный механизм хлорирования метана
В присутствии катализаторов (кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
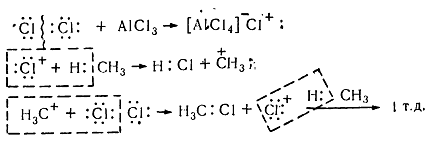
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.












