Механизм галогенирования гомологов метана также является цепным радикальным и мало отличается от механизма галогенирования самого метана, однако при галогенировании пропана, бутана и других алканов всегда образуется смесь не только продуктов полигалогенирования, но и смесь изомерных продуктов замещения одного атома водорода на галоген.
Хлорирование гомологов метана
Хлорирование этана происходит аналогично хлорированию метана. На первой стадии реакции образуется хлористый этил, который может хлорироваться дальше:
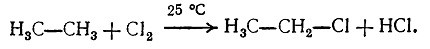
Рисунок 1. Галогенирование гомологов метана
При хлорировании высших алканов место внедрения галогена в их молекулах (место замещения) зависит от строения углеводорода и природы галогена. Существующая при этом определенная избирательность называется региоселективнисть реакции галогенирования (от лат. regio - участок, часть пространства, selectio - выбор).
Известно, что легче связи $C-H$ расщепляются у третичного атома углерода, дальше у вторичного и потом у первичного - согласно энергиями их диссоциации и стабильности в создаваемых при этом радикалов. При низких температурах, от комнатной до $300^\circ \ C$, соотношение скоростей отщепления атома водорода от алкана под действием атома хлора от первичного, вторичного и третичного атомов углерода составляет примерно 1: 4: 5. С учетом количества соответствующих атомов водорода, способных быть замещены атомами хлора, такое соотношение скоростей можно связать с соотношением количества образованных хлоропроизводных.
Например, хлорирование пропана приводит к образованию хлорпроизводных с соотношением изомеров:
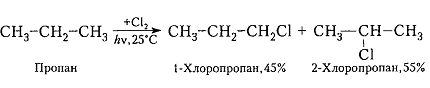
Рисунок 2. Галогенирование гомологов метана
В пропане существуют шесть первичных и два вторичных атома водорода, их соотношение составляет 6:2 или 75:25. При отсутствии селективности соотношение монохлорпроизводных изомеров 1-хлорпропан: 2-хлорропан было бы также 75:25, а в действительности между ними существует соотношение 45:55.
Таким образом, при хлорировании в условиях относительно низких температур наблюдается селективность процесса. Быстрее реакция проходит у третичного атома углерода с образованием соответствующего соотношения галогенпроизводных, которое зависит от упомянутого соотношение 1: 4: 5.
Для высоких температур ($ > 450^\circ \ C$) региоселективнисть галогенирования уменьшается, и соотношение скоростей меняется от 1: 4: 5 до 1: 1: 1. При таких условиях практически каждое столкновение имеет достаточную энергию для отщепления атома водорода от алкана. И наоборот - снижение температуры всегда увеличивает селективность галогенирования. Вероятно, что реакция переходит при этом от условий кинетического контроля в условиях термодинамического.
При хлорировании гомологов метана, в молекулах которых кроме первичных есть вторичные, третичные углеродные атомы, с одной насыщенного углеводорода может образовываться несколько изомерных продуктов в зависимости от того, какой атом водорода замиститься. Так, пропан, н-бутан и изобутан при хлорировании на свету на первой стадии реакции образуют смесь двух изомерных хлоропохидних:
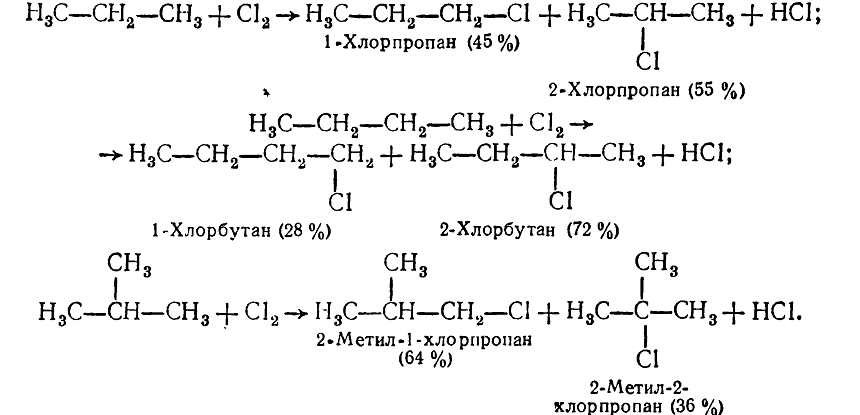
Рисунок 3. Галогенирование гомологов метана
Таким образом, реакционная способность атомов водорода и селективность хлорирования зависит от температуры (рис. 4).
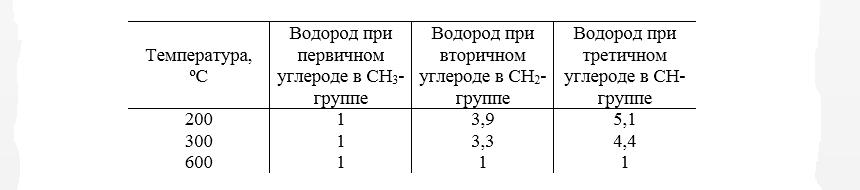
Рисунок 4. Зависимость селективности свободнорадикального хлорирования от температуры
Рассмотрение хлорирования алканов при помощи метода молекулярных орбиталей
Суть реакций между радикалами или атомами и алканами состоит в том, что в нех участвуют однократно (одноэлектронно) занятые молекулярные орбитали (ОЗМО) радикалов или атомов. ОЗМО можгут или отдавать или принимать один электрон, т.е. в реакцию может вовлекаться как НСМО, так и ВЗМО алканов.
Рассмотрим для примера взамодействия атомов хлора с метаном (рис. 5). В этом случае энергетические уровни ОЗМО атомов хлора и ВЗМО метана ближе, чем энергетические уровни ОЗМО и НСМО, и возмущения между ОЗМО и ВЗМО будут главными.
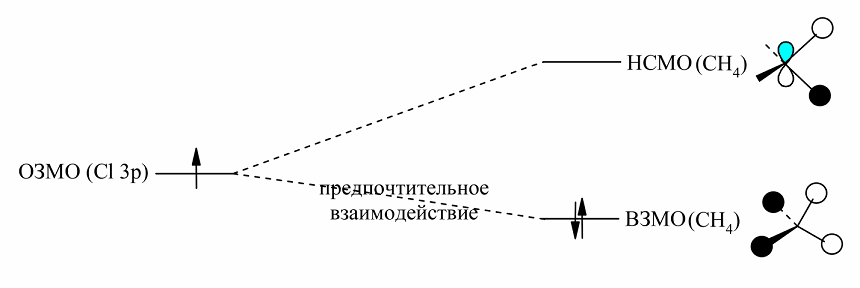
Рисунок 5. Схема, иллюстрирующая предпочтительное взаимодействие ОЗМО атома хлора с ВЗМО метана. Метан имеет три вырожденные НСМО. Для простоты здесь приведены лишь эскизы для одной из трех ВЗСО и НСМО
В пропане (и других линейных алканах) ВЗМО находятся в основном на атомах углерода (рис. 6) и подходы к этой ВЗМО типа $\sigma C-C$ пространственно затруднены (иначе бы при хлорировании разрывались связи $C - C$).
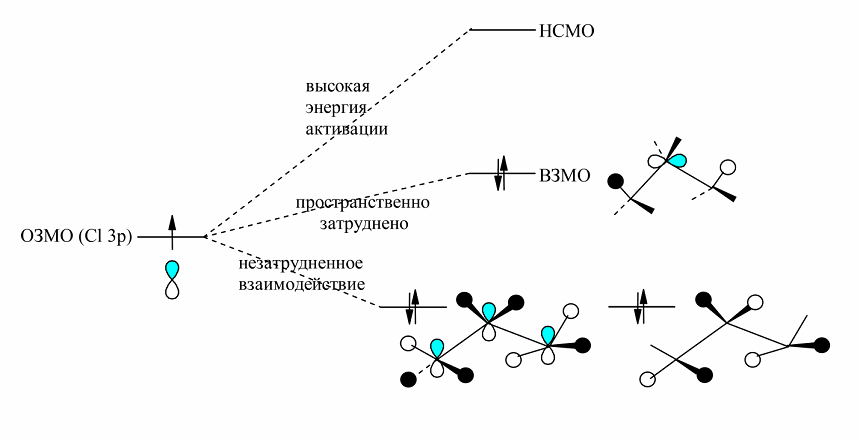
Рисунок 6. Объя снение предпочтительного отщепления водорода от центрального атома пропана
Значит, реакция гомологов метана с атомами хлора не может идти путем взаимодействий ВЗМО ($C_3H_8$) - ОЗМО $(Cl)$. Взаимодействия ОЗМО -- НСМО имели бы высокие энергий активации, так как эти орбитали сильно различаются по энергии. Однако в гомологах метана ниже ВЗМО лежит пара почти вырожденных орбиталей, где высшая электронная плотность находится у атомов водорода, которые связанны с центральными атомами углерода. Следовательно, атака атомом хлора с точки зрения теории молекулярных орбиталей должна происходить по атомам водорода в положении 2. Это согласуется с выводами, основанными на рассмотрении энергии связей $C_1 - H$ и $C_2 - H$ в алканах.
Бромирование гомологов метана
Алканы способны бромироваться. В этом легко убедиться, проведя такой опыт. Если к гексану в темноте добавить каплю брома, то окраска брома сохраняется в течение многих дней. Под воздействием солнечного света окраски брома в гексане исчезает через несколько минут, поскольку в молекуле гексана происходит фотохимическое замещения атома водорода на бром.
Подача воздуха в отверстия посуды с реакционной смесью вызывает появление белого тумана, который свидетельствует об образовании в результате реакции бромоводорода.
Бромирования алканов происходит с выделением 39,8 кДж / моль теплоты и является намного менее экзотермическим процессом, чем реакция хлорирования. Поэтому скорость реакции бромирования значительно меньше по сравнению с хлорированием. Механизм бромирования на свету, как и хлорирования, - цепной, радикальный. Фотохимическое бромирование гомологов метана значительно селективнее, чем хлорирование, относительно тех атомов водорода, которые замещаются:
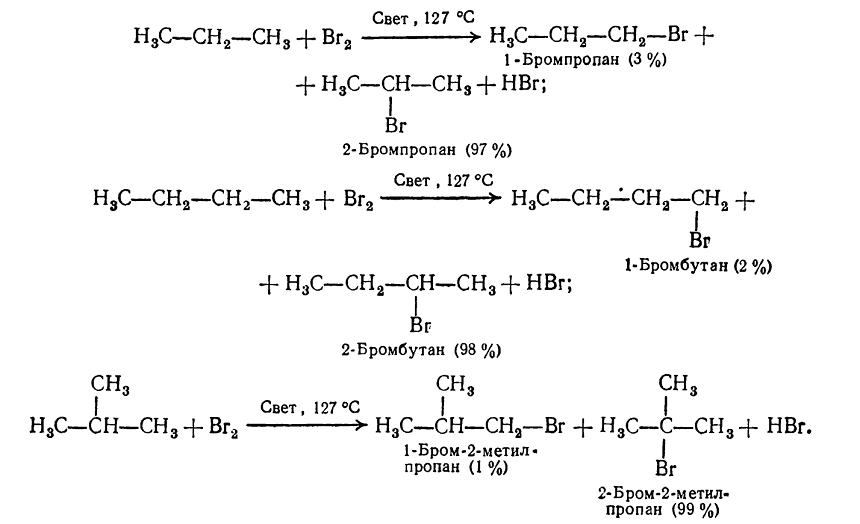
Рисунок 7. Галогенирование гомологов метана
Значительное повышение избирательности замещения атомов водорода на бром связано с медленным течением реакции бромирования.
Йодирование гомологов метана
Реакция йодирования алканов эндотермическая. Для того чтобы произошло взаимодействие атомов йода с алканами, необходима достаточно высокая энергия - 129 кДж / моль. Это обусловливает смещение равновесия этой реакции нацело в левую сторону. Наоборот, известно, что йодалканы под действием НJ легко превращаются в алканы и йод. Поэтому йод практически не реагирует с насыщенными углеводородами даже при температуре $300^\circ \ C$.
Йод сравнительно легко распадается на радикалы, однако последние малоактивны, поэтому они не реагируют далее с субстратом (в данном случае с алканами). Они взаимодействуют лишь с радикалами, образовавшимися другими путями, обрывая таким образом цепь. В связи с этим становится ясным тот факт, что йод является ингибитором свободнорадикальных реакций.












