Понятие водородная связь
Атом водорода, связанный с сильно электроотрицательным атомом (кислорода, фтора, хлора, азота) может взаимодействовать с неподеленной электронной парой другого сильно электроотрицательного атома этой или другой молекулы с образованием слабой дополнительной связи -- водородной связью. При этом может установиться равновесие
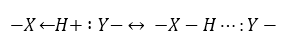
Рисунок 1.
Появление водородной связи предопределено исключительностью атома водорода. Атом водорода гораздо меньше, чем другие атомы. Электронное облако, образованное им и электроотрицательным атомом сильно смещено в сторону последнего. В результате ядро водорода остается слабоэкранированным.
Атомы кислорода гидроксильных групп двух молекул карбоновых кислот, спиртов или фенолов могут близко сходиться из-за образования водородных связей.
Положительный заряд ядра атома водорода и отрицательный заряд другого электроотрицательного атома притягиваются. Энергия их взаимодействия сопоставима с энергией прежней связи, поэтому протон оказывается связанным сразу с двумя атомами. Связь со вторым электроотрицательным атомом может быть более сильной, чем первоначальная связь.
Протон может передвигаться от одного электроотрицательного атома к другому. Энергетический барьер у такого перехода незначительный.
Водородные связи относятся к числу химических связей средней силы, но, если таких связей много, то они способствуют образованию прочных димерных или полимерных структур.
Образование водородной связи в $\alpha $-спиральной структуре дезоксирибонуклеиновой кислоты, алмазоподобная структура кристаллического льда и др.
Положительный конец диполя в гидроксильной группе находится у атома водорода, поэтому через водород может формироваться связь с анионами или электроотрицательными атомами, содержащими неподеленные электронные пары.
Практически во всех других полярных группах положительный конец диполя расположен внутри молекулы и поэтому является трудно доступным для связывания. У карбоновых кислот $(R=RCO)$, спиртов $(R=Alk)$, фенолов $(R=Ar)$ положительный конец диполя $OH$ находится снаружи молекулы:
Примеры нахождения положительного конца диполя $C-O, S-O, P-O$ внутри молекулы:
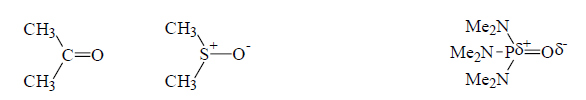
Рисунок 2. Ацетон, диметилсульфоксид (ДМСО), гексаметилфосфортриамид (ГМФТА)
Так как стерические препятствия отсутствуют, водородная связь образуется легко. Ее сила, в основном определяется тем, что она преимущественно имеет ковалентный характер.
Обычно наличие водородной связи обозначают пунктирной линией между донором и акцептором, например, у спиртов
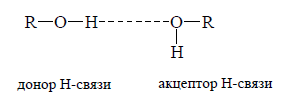
Рисунок 3.
Как правило, расстояние между двумя атомами кислорода и водородной связи меньше суммы ван-дер-ваальсовых радиусов атомов кислорода. Должно присутствовать взаимное отталкивание электронных оболочек атомов кислорода. Однако силы отталкивания преодолеваются силой водородной связи.
Природа водородной связи
Природа водородной связи заключается в электростатическом и донорно -- акцепторном характере. Основную роль в формировании энергии водородной связи играет электростатическое взаимодействие. В образовании межмолекулярной водородной связи принимают участие три атома, которые располагаются почти на одной прямой, но расстояния между ними, при этом, различны. (исключение составляет связь $F-H\cdots F-$).
Для межмолекулярных водородных связей во льду $-O-H\cdots OH_2$ расстояние $O-H$ равно $0,097$ нм, а расстояние $H\cdots O$ равно $0,179$ нм.
Энергия большинства водородных связей лежит в пределах $10-40$ кДж/моль, а это намного меньше энергии ковалентной или ионной связи. Часто можно наблюдать, что прочность водородных связей возрастает с увеличением кислотности донора и основности акцептора протона.
Значение межмолекулярной водородной связи
Водородная связь играет существенную роль в проявлениях физико -- химических свойств соединения.
Водородные связи оказывают следующее влияние на соединения:
-
они обуславливают ассоциацию соединений (карбоновых кислот, спиртов), что приводит к появлению высоких температур кипения этих соединений;
Например: уксусная кислота даже в газовой фазе существует в виде димера.
-
сольватация соединений посредством образования водородных связей с растворителем существенно повышает их растворимость;
-
способствуют стабилизации ионизированных частиц в растворе, например межмолекулярные водородные связи в соединениях А,Б,В:
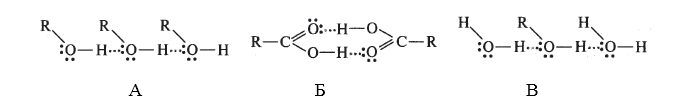
Рисунок 4.где А -- ассоциация молекул спирта, Б -- димеры карбоновых кислот, В -- гидратация молекул спирта.
-
важны при формировании пространственной структуры нуклеиновых кислот, белков, полисахаридов и др. соединений;
-
участвуют в осуществлении ряда биохимических процессов (синтез мРНК, репликация ДНК);
-
обеспечивают связывание лекарственных препаратов с рецепторами и т.д.
Внутримолекулярные водородные связи
В случаях, когда возможно замыкание шестичленного или пятичленного цикла, образуются внутримолекулярные водородные связи.
Наличие внутримолекулярных водородных связей в салициловом альдегиде и о-нитрофеноле является причиной отличия их физических свойств от соответствующих мета- и пара-изомеров.
$o$-Гидроксибензальдегид или салициловый альдегид $(A)$ и $o$-нитрофенол (Б) не образуют межмолекулярные ассоциаты, поэтому имеют более низкие температуры кипения. Они плохо растворимы в воде, так как не участвуют в образовании межмолекулярных водородных связей с водой.
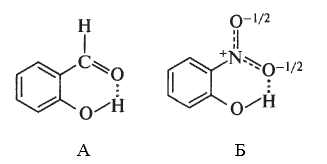
Рисунок 5.
$o$-Нитрофенол является единственным из трех изомерных представителей нитрофенолов, который способен перегоняться с водяным паром. На этом свойстве основано его выделение из смеси изомеров нитрофенола, которая образуется в результате нитрования фенолов.












