Межмолекулярное взаимодействие включает как процессы притяжения молекул друг к другу, так и процессы отталкивания.
Когда электронные оболочки атомов молекул при сближении начинают соприкасаться, вступают в действие силы отталкивания. Силы отталкивания действуют на очень маленьких расстояниях и зависят от индивидуального строения молекул.
На больших расстояниях атомы гелия слабо притягиваются друг к другу, но если их очень приблизить, то они начинают отталкиваться. Гелий является инертным газом, имеющим на внешнем электронном слое два электрона, поэтому не может образовывать молекулы. Поскольку, согласно принципу Паули, заполненные электронные оболочки не могут проникать друг в друга, начинают возрастать силы отталкивания.
Силы отталкивания обладают потенциальной энергией $U_{от}$. С уменьшением расстояния, эта энергия будет возрастать. В данном случае, значение потенциальной энергии подчиняется зависимости $U_{от} (r) ~ r{-12}$, а величина сил отталкивания $F_{от} (r) ~ r{-13}$. Значение потенциальной энергии будет минимальным на расстоянии, при котором величина сил взаимодействия равна нулю.
Расстояние $r_0$ (Рис. 1) равно сумме радиусов молекул. Результирующая сила $F_r$ будет равна нулю, так как силы притяжения и отталкивания по модулю равны. Сила притяжения будет больше силы отталкивания, если расстояние $r > r_0$. При этом проекция результирующей силы -- отрицательна. При значениях $r > \infty$ результирующая сила также будет стремиться к нулю.
Сила отталкивания будет превосходить силу притяжения в случаях, когда расстояние $r
На Рис. 1 изображенная проекция силы отталкивания положительная, силы притяжения - отрицательная.
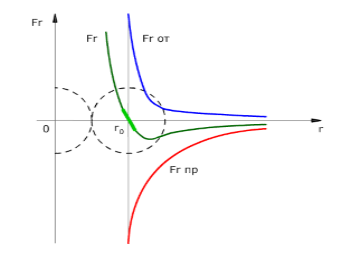
Рисунок 1. Зависимость сил отталкивания Fот, притяжения Fпр от расстояния между центрами молекул
Энергию отталкивания можно охарактеризовать выражением:
$E = \frac{k}{r^n}$,
где $k$- постоянная отталкивания;
$n$ - коэффициент, которй может принимать целые значения от 5 до15.
Потенциал Леннарда - Джонса
Точно рассчитать потенциальную энергию сил отталкивания на основе квантовой механики сейчас сложно из-за многообразия пар взаимодействующих друг с другом молекул. В настоящее время для нахождения значения энергии взаимодействия частиц используют потенциал Леннарда -- Джонса:
где $r$ - расстояние между центрами частиц;
$\varepsilon$ - глубина потенциальной ямы;
$\sigma $ -- расстояние, при котором энергия становится равной нулю.
Потенциал Леннарда -- Джонса описывает взаимодействие между частицами: на малых расстояниях -- сил отталкивания, на больших -- сил взаимодействия.
Величины $\sigma $ и $\varepsilon$ являются характеристиками вещества. Потенциал Леннарда-Джонса описывает взаимодействие двух неполярных сферических молекул, поэтому не подходит для характеристики несферических или полярных молекул.
Ван-дер-ваальсовы радиусы
Ван--дер--ваальсовое расстояние -- это расстояние, при котором силы притяжения равны силам отталкивания.
Для соприкасающихся атомов двух молекул ван--дер--ваальсовое расстояние зависит от:
-
природы атомов, входящих в состав молекулы;
-
относительной ориентации атомов по отношению к ковалентным связям.
Ван--дер--ваальсовые расстояния -- это сумма ван--дер--ваальсовых радиусов пары атомов. Величина этих радиусов равна половине межъядерного расстояния между не связанными одноименными атомами, принадлежащими разным молекулам.
Ван-дер-ваальсовы радиусы характеризуют возможные минимальные взаимодействия атомов, которые принадлежат разным молекулам. Если расстояние, на которое сближаются атомы, меньше, чем сумма их ван-дер-ваальсовых радиусов, то появляется межатомное отталкивание.
Ковалентные радиусы определяют длину ковалентной связи между парой атомов. Ван -- дер -- ваальсовы связи длиннее ковалентных (приблизительно на $0,08$ нм), но по прочности им уступают. Для анионов (например, $F^-$, $Br^-$, $Cl^-$) в нейтральном состоянии ионный радиус практически равен ван-дер-ваальсовому радиусу.
Ван-дер-ваальсовы радиусы позволяют:
-
определять форму молекул;
-
характеризовать конформации молекул;
-
определять наиболее стабильные конфигурации органических молекул;
-
устанавливать расположение молекул в молекулярных кристаллах;
-
предсказывать структуру кристаллов;
-
определять размеры атомов благородных газов.
Молекула трет -- бутилциклогексана имеет форму «кресла», при этом трет-бутильная группа занимает положение на экваторе. Из-за большого ван-дер-ваальсового радиуса трет-бутильная группы, в аксильной конформации проявляется отталкивание между данной группой и аксильными атомами водорода в положения $3$, $5$. Возникает $1,3$ -диаксиальное отталкивание.













