Ковалентная (гомеополярная) связь образуется при взаимодействии одинаковых атомов или же атомов, которые имеют близкое по величине сродство к электрону. Так, ковалентно связаны атомы в молекулах соединений типа H2, C12, IBr и др. К ковалентным относятся и большинство связей между атомами в органических соединениях.
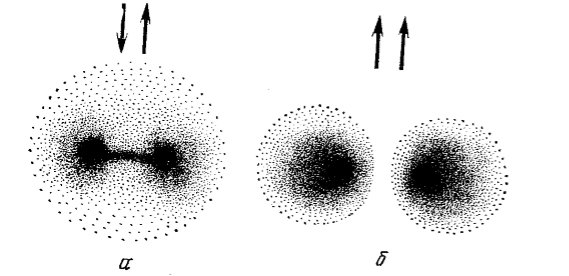
Рисунок 1. Перераспределение электронной плотности в атомах водорода при их сближении: а электроны разных атомов имеют антипараллельные спины; б --- электроны имеют параллельные спины
Образование ковалентной химической связи в согласии с положениями квантовой теории можно объяснить следующим образом. При сближении двух электронных облаков с антипараллельными спинами их волновые функции складываются, т. е. электронные облака как бы вытягиваются навстречу друг другу и перекрываются.
Электронные облака, каждое из которых до этого обращалось вокруг ядра одного атома на атомной орбитали (АО), после перекрывания образуют общую молекулярную орбиталь МО.
Образование молекулярных σ-орбиталей
В простейшем графическом виде молекулярную орбиталь, как линейную комбинацию атомных орбиталей, можно получить, складывая или вычитая волновые функции, приведенные на рис. 2.
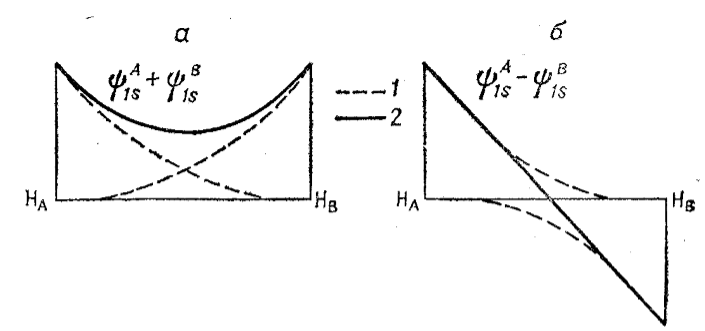
Рисунок 2. Перекрывание волновых функций атомов водорода при сложении (а) и вычитании (б) этих функций.
Атомные орбитали могут образовывать молекулярные орбитали, если энергии соответствующих атомных орбиталей близки по величине и атомные орбитали имеют одинаковую симметрию относительно оси связи.
Примеры образования σ- молекулярных орбиталей в некоторых веществах
Волновые функции, или орбитали, водорода 1s могут дать две линейные комбинации --- одну при сложении (рис. 2, а), другую при вычитании (рис. 2,6). Когда волновые функции складываются (рис. 2, а), то в области перекрывания плотность электронного облака, пропорциональная Ψ2, становится больше, между ядрами атомов создается избыточный отрицательный заряд и ядра атомов притягиваются к нему.
Молекулярная орбиталь молекулы водорода, полученная сложением волновых функций атомов водорода, называется связывающей (рис. 3, а). Если волновые функции вычитаются (рис. 3, а), то в области между ядрами атомов плотность электронного облака становится равной нулю, электронное облако «выталкивается» из области, находящейся между атомами. Образующаяся молекулярная орбиталь (рис. 3,б) не может связывать атомы и называется разрыхляющей молекулярной орбиталью.
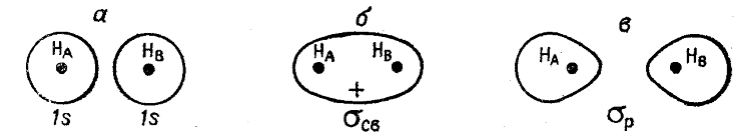
Рисунок 3. Образование связывающих σсв (б) и разрыхляющих σP (в) орбиталей из атомных 1s-орбиталей (а)
Появление в пространстве между ядрами атомов области с высокой плотностью отрицательного заряда будет стягивать положительно заряженные ядра, что значительно понижает потенциальную энергию электронов, незначительно увеличивая их кинетическую энергию. Общая энергия системы уменьшается, и за счет этого возникает химическая связь. Схемаобразования молекулярной орбитали на примере молекулы водорода показана на рис. 4, а.
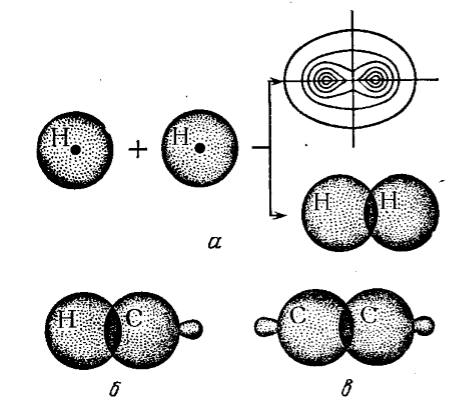
Рисунок 4. Схема образования σ-связей: а --- образование σ-связи за счет перекрывания s-электронных облаков атомов водорода (показано образование молекулярной орбитали); б --- образование σ-связи s-электроном водорода и sp3-гибридизированным электроном углерода; в --- образование σ-связи двумя sp3-гибридизированными электронами разных атомов углерода
Молекулярная орбиталь, образованная благодаря взаимному перекрыванию двух атомных орбиталей вследствие уплотнения электронных облаков атомов, имеет яйцевидную форму (рис. 4, а) и симметрию на оси, связывающей два соединившихся атома. Такая связь считается простой. Она может быть образована либо двумя s-электронами (s−s-связь), либо одним s− и одним p-электронами (s−p-связь), или же двумя гибридизированными электронами. Она названа сигма-связью (σ-связь). Схема таких связей показана на рис. 4, б и в. Энергия этой связи - 350 кдж/моль (83,6 ккал/моль). Расстояние между объединившимися атомами (длина связи) определяется устанавливающимся равновесием между силами притяжения (возникшими из-за перекрывания электронных облаков с противоположными спинами) и силами отталкивания сближающихся атомных ядер.
Закономерности образования σ- молекулярных орбиталей в органических веществах
Наибольшее перекрывание гибридизированных облаков s− и р-электронов имеет место при их тетраэдрическом взаимном расположении, т. е. под углом в 109,5∘ Именно поэтому такие связи должны быть наиболее прочными и они характерны для наиболее устойчивых в химическом отношении молекул предельных углеводородов. В предельных углеводородах валентные электроны атомов углерода находятся в состоянии sp3-гибридизации, и каждый его атом образует четыре простых (одинарных) ковалентных связи перекрыванием четырех гибридизированных орбиталей с орбиталями других атомов без нарушения их взаимного расположения в пространстве.
В органических соединениях, кроме одинарных (ковалентных) химических связей между атомами углерода (C−C), распространены также кратные связи: двойные (C=C связи) и тройные (C=C связи). Двойная связь возникает при взаимодействии двух атомов углерода, электроны которых находятся в sp2-гибридизации. Данный вопрос будет рассмотрен в последующих главах.


















