Накопление обильного фактического материала в области химии и развитие теории строения атома привели к установлению электрической природы химической связи. В этом отношении электронная теория гомеополярной связи Льюиса являлась дальнейшим шагом в развитии структурной теории Бутлерова; она была попыткой связать новые положения строения атома со структурной теорией. По Льюису химическая связь обусловлена взаимодействием двух электронов по одному от каждого атома; иначе говоря, два электрона, принадлежащие разным атомам, образуют гомеополярную или, так называемую, ковалентную связь. При этом оказалось, что во многих случаях стало возможным в простой форме установить соотношение между ранее известными фактами. Поэтому идеи Льюиса до появления квантовой механики нашли большой отклик среди химиков. Однако, теория Льюиса не могла объяснить целый ряд явлений; она сталкивалась с большими трудностями принципиального характера. Следует отметить, что представления Льюиса об электронной паре в уточненном виде получили теоретическое обоснование в квантовой механике.
Развитие квантовой механики и ее применение к вопросам теории химического строения подтвердило целый ряд положений органической химии, которые были найдены опытным путем или были выведены на основе теории химического строения. Применение квантовой механики внесло в химию ряд новых важных представлений и понятий. Вместе с тем необходимо отметить, что изучение химического строения молекул и механизма образования химической связи на основании квантовой механики приводит к проблеме многих центров, которая часто не поддается решению. Достаточно сказать, что за исключением отдельных состояний ионизованной молекулы водорода уравнение Шредингера для молекул до сих пор точно не решено. Вследствие математических трудностей обычно применяются приближенные методы, которые в некоторых случаях (например, для молекулярного водорода и молекулярного иона водорода дают результаты с точностью, сравнимой со спектроскопической.
В квантовой теории валентности в основном применяются два приближенных метода: метод электронных пар, или метод направленной валентности, который является дальнейшим развитием метода Гейтлера—Лондона Румером—Слейтером—Полингом и метод молекулярных орбит, разработанный Гундом—Мулл и Кеном—Лепнард—Джонсом и др.
Метод МО
В основе метода молекулярных орбиталей лежит представление о молекуле как единой системе из ядер и электронов и о молекулярных орбиталях. Каждый электрон в такой системе претерпевает притяжения со стороны всех ядер и отталкивания со стороны всех остальных электронов. Каждой молекулярной орбитали соответствует определенная энергия. Молекулярные орбитали могут быть трех типов: связующие; несвязующие и разрыхляющие. Молекулярную орбиталь, энергия которой выше энергию исходной атомной орбитали, называют разрыхляющий. Молекулярную орбиталь с энергией, равной энергии исходной атомной орбитали, называют несвязующий. Молекулярную орбиталь, с энергией ниже энергии исходной атомной орбитали, называют связующей. Совокупность молекулярных орбиталей, занятых электронами, определяет электронную конфигурацию молекулы. Она строится на тех же принципах, что и электронная конфигурация многоэлектронного атома (минимум энергии, принцип Паули, правило Хунда). Как правило, основном состояния молекулы соответствует конфигурация с полностью занятыми связывающими молекулярными орбиталями. Таким образом, каждый электрон в молекуле находится на определенной молекулярной орбитали, подобно тому, как в атоме каждый электрон находится на определенной атомной орбитали. При этом надо помнить, что число молекулярных орбиталей всегда равно числу исходных атомных орбиталей, участвующих в линейной комбинации. Основному состоянию соответствует одно единственнре распределение электронов на молекулярных орбиталях, другие распределения будут возбужденными. При переходе из основного в возбужденное состояние энергия поглощается, при обратном переходе - излучается в виде кванта.
Построение $\sigma$- и $pi$- орбиталей
Поскольку для каждой молекулы имеется строго определенный набор энергетических уровней (МО), молекула характеризуется своим спектром. Аналогично удаления электрона из молекулярной орбитали соответствует определенному потенциалу ионизации, а присоединение электрона (заселение им самой низкой по энергии свободной МО) - сродства к электрону. Энергия молекулярной орбитали зависит от соотношения энергий исходных атомных орбиталей. Поэтому чем ближе энергия последних, тем выигрыш в энергии молекулярной орбитали больше. Атомные орбитали с низкой энергией локализованы вблизи ядер и практически в образовании молекулярных орбиталей не участвуют. Это же относится и к высоко расположенных вакантных атомных орбиталей (конечно, для основного состояния молекулы). Рассмотрим, например, МО, образующихся при соединении двух атомов кислорода, каждый из которых имеет на последнем уровне одну $2s-$ и три $2p-$ орбитали, которые могут взаимодействовать между собой по типу $\sigma-$ или $\pi$- перекрытия и образовывать связывающие или разрыхляющие молекулярные орбитали. Две $2p$- орбитали взаимодействуют с образованием двух МО (связующего и разрыхляющего) по типу $\sigma$- перекрытия. На каждой из них находится по два электрона:
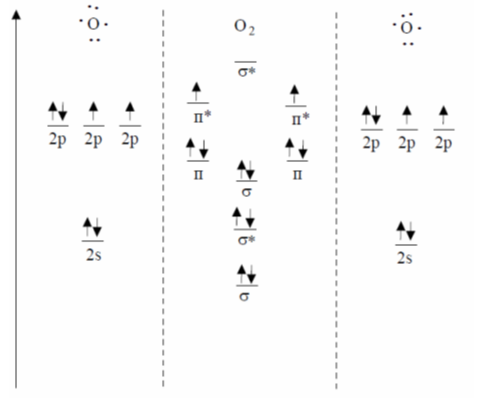
Рисунок 1.
Шесть $2p$- орбиталей взаимодействуют между собой с образованием шести МО (три связывающие и три разрыхляющие) по типу $\sigma$- и $\pi$- перекрытия. Для того, чтобы разместить на них восемь выходных $p$ электронов атомов кислорода, необходимо два из них поместить на $\pi$* - орбиталь молекулы диоксигену (правило Хунда). Этот набор из двух неспаренных электронов приводит парамагнетизм молекул диоксигену и объяснение его природы является одним из триумфов теории молекулярных ориталей. В методе молекулярных орбиталей число связей между атомами заменяется понятием кратности связи. Кратность связи определяется как половина разности количества электронов на связывающих и разрыхляющих орбиталях.
Контурные диаграммы молекулярных орбиталей
По критерию минимума энергии метод МО позволяет определить устойчивые молекулярные конфигурации некоторых молекул в зависимости от направления связей и, следовательно, дает возможность судить о направленности валентности. При этом, оказывается необязательно исходить из представления о существовании локализованных пар.
Контурные диаграммы молекулярных орбиталей, пример которых был рассмотрены выше, был получен с помощью компьютерных расчетов. Контурные диаграммы дают объемное представление о пространственных формах орбитали, которые характеризуют распределения плотностей в данных занятых или незанятых орбиталях по отдельному атомаму молекулы. Вклады каждой отдельной атомной орбитали в рассматриваемой МО. Суммируя каждый вклад АО отдельного атома по всем связующим МО, мы получим картину распределения электронных плотностей в молекулах. Распределения плотностей граничных орбиталей ВЗМО и НСМО дает представление о преимущественном месте атаки нуклеофилов или электрофилов, т.е. об пространственной ориентации в реакциях присоединения или замещения с участием данной молекулы. Также разработан качественный метод графического изображения молекулярных орбиталей, основанный на представлениях МО в виде определенных комбинаций «кружков» и «гантелей» (или «розеток» в случае участия $d$-орбиталей). Хотя этот метод и не дает точной картины, симметрию и узловые свойства орбиталей он передает правильно. Метод основан на теории ВМО.











