Орбитали молекулы этилена можно построить из двух фрагментов $CH_2$, имеющих ангулярную форму. Орбитали этих фрагментов в свою очередь строятся из орбиталей атома углерода и групповых орбиталей ансамбля Н2, полученного путем удаления двух атомов водорода их тетраэдрического ансамбля $H_4$:
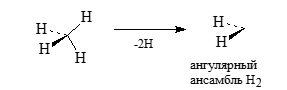
Рисунок 1.
Диаграмма орбитального взаимодействия для ангулярного фрагмента $CH_2$ приведена на рис. 2.
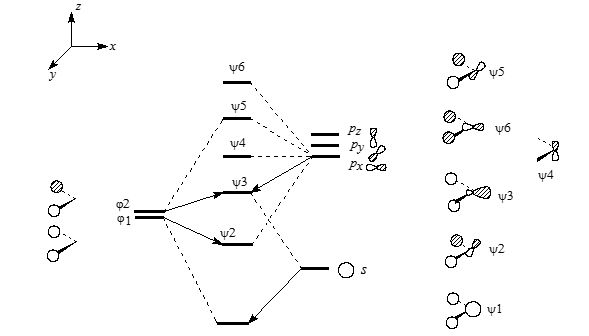
Рисунок 2. Диаграмма орбитального взаимодействия для ангулярного фрагмента $CH_2$
Теперь мы можем построить молекулярные орбитали молекулы этилена, объединив два ангулярных фрагмента $CH_2$, как показано на рис. 3 (приведены лишь четыре из шести орбиталей фрагмента $CH_2$).
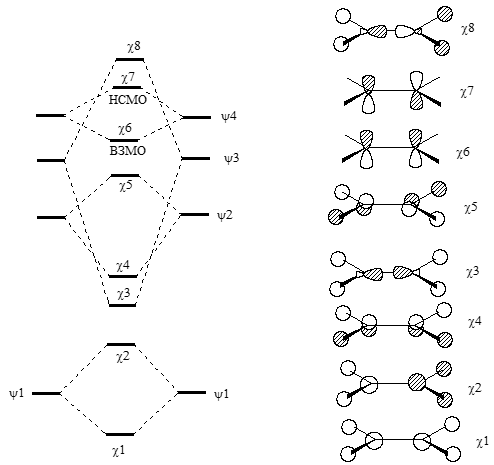
Рисунок 3. Образование МО этилена из ангулярных фрагментов $CH_2$
Электронная конфигурация молекулы этилена
Кроме $\sigma $-связей, органические молекулы могут иметь делокализованные $\pi $-орбитали. Например, электронную структуру этилена можно описывать с помощью четырех $\sigma $-связей $C-H$ и одной $\sigma $-связи $C-C$:
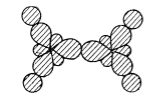
Рисунок 4.
Каждой из этих связей соответствуют уровни $\sigma $ и $\sigma $*. На $\sigma $-уровнях расположены пять пар электронов. Остаются два электрона и две атомные р-орбитали, перпендикулярные плоскости молекулы:.
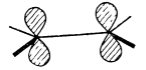
Рисунок 5.
$p$-Орбитали комбинируют с образованием $\pi $- и $\pi $*-орбиталей, отличающихся отсутствием или наличием узла между атомами (рис. 6).
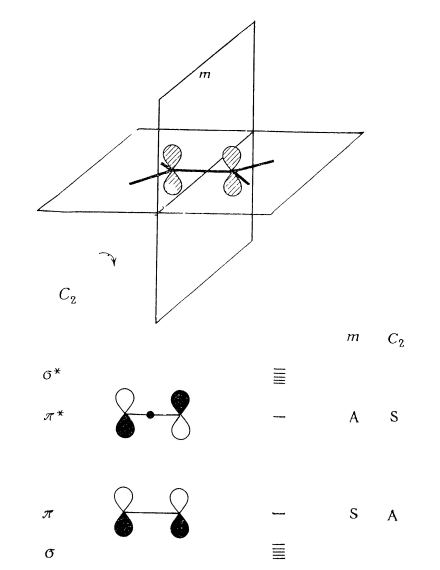
Рисунок 6. Молекулярные орбитали этилена и свойства симметрии $\pi $- и $\pi $*-орбиталей. Горизонтальные линии указывают относительные энергии орбиталей
Существуют две независимые операции симметрии, которые могут быть использованы для классификации этих орбиталей: отражение в зеркальной плоскости т, перпендикулярной плоскости молекулы и рассекающей молекулу пополам, и поворот вокруг оси вращения второго порядка $C_2$, проходящей через центр связи углерод---углерод. Следует подчеркнуть, что свойства симметрии орбиталей молекулы этилена при каждой из указанных операций симметрии противоположны. Так, $\pi $-орбиталь симметрична ($S$) относительно отражения в зеркальной плоскости т и антисимметрична ($A$) относительно вращения вокруг оси $C_2$.
Перекрывание двух $2p_z$-орбиталей значительно меньше, чем перекрывание при $\sigma $-взаимодействии, и, таким образом, $\pi $-связь слабее, чем $\sigma $-связь, а уровни $\pi $ и $\pi $ находятся выше и ниже уровней $\sigma $ и $\sigma $ соответственно (рис. 6).
Итоговая картина молекулярных орбиталей этилена показана на рисунке 7.
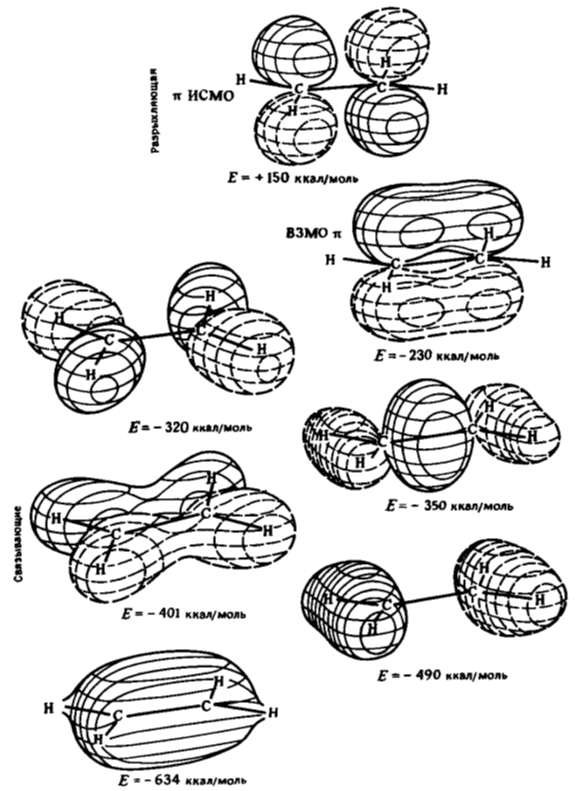
Рисунок 7. Молекулярные орбитали этилена


















