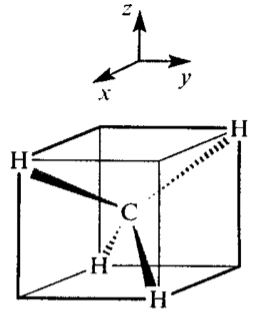
На рис.1 показано расположение атомов водорода молекулы $CH_4$ в вершинах куба, что соответствует тетраэдрической модели. Атом углерода находится в центре куба и имеет четыре валентные орбитали: $2s-$, $2p_x$, $2p_y^-$ и $2p_z^-$ (рис.2а); $2p$-орбитали направлены вдоль осей координат.
Каждая из четырех $1s$-АО атомов водорода может иметь, как положительный, так и отрицательный знак. Следовательно, можно предположить различные комбинации знаков этих орбиталей. Исходя из четырех атомных орбиталей можно получить четыре групповые орбитали лигандов (ГОЛ) (рис.2б), т.к. число образуемых ГОЛ равно общему числу исходных атомных орбиталей. Синфазная комбинация АО (знаки всех АО одинаковы) обозначена как ГОЛ 1.
Теперь используем связь между тетраэдром и кубом (рис. 1) каждая из плоскостей $xy$, $xx$ и $yx$ делит куб в различных направлениях. Например, на рис.1 два атома водорода лежат выше плоскости $xy$, а два - ниже. Аналогичная ситуация наблюдается и для плоскостей $xx$ и $yx$. В случае ГОЛ 2 четыре исходные атомные орбитали разделены плоскостью $yx$ на две пары: орбитали каждой пары синфазны друг другу и находятся в противофазе по отношению к орбитлям второй пары. Аналогичные рассуждения могут быть проведены и для ГОЛ 3 и ГОЛ 4.
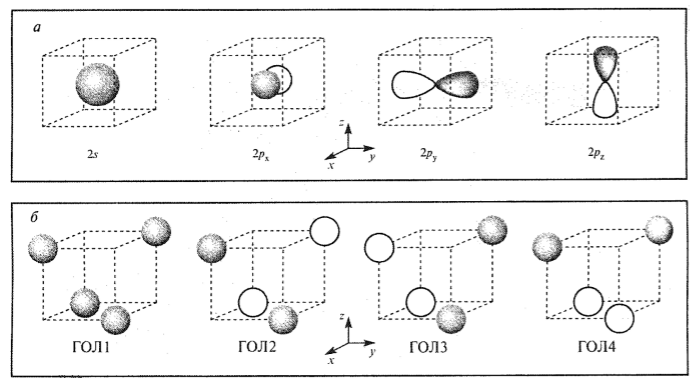
Рисунок 2. Групповые орбитали лигандов молекулы CH4
Алгоритм построения энергетической диаграммы CH4
-
Определение центрального атома
В молекуле $CH_4$ центральный атом - атомуглерода $C$. Его энергетическая диаграмма слева на рисунке. На ней отмечены все валентные АО, т.е. АО второго энергетического уровня. Обращаем ваше внимание, что изображаются не только АО с неспаренными электронами, но именно все валентные АО. Нам не требуется понятие о «возбужденных» состояниях.
-
Определение атомов-лиганд
В молекуле $CH_4$ атомы-лиганды -- четыре атома $H$. На правой оси отмечаем энергии АО лигандов, участвующих в образовании связей, т.е. по одной орбитали от каждого лиганда, именно той, которая направлена к центральному атому. В случае метана это требование излишне, т.к. лиганды --- атомы водорода --- имеют лишь по одной АО. Однако это правило приобретет смысл для более сложных лигандов.
Отметим, что именно $\sigma $-связи определяют геометрию молекулы, поэтому с них и начинаем.
Все $2p$-АО одинаковы. Но в целях экономии места на рисунке они изображены на разных уровнях (мы об этом уже говорили).
При выборе положения уровня энергии АО лигандов на энергетической оси желательно согласовывать его по отношению к уровням энергии центрального атома. Чем легче оторвать электрон от атома, т.е. чем ниже ионизационный потенциал, тем выше располагаются соответствующие АО на оси энергий.
-
Построение исходных АО принимающих участие в образовании связей
В молекуле $CH_4$ восемь АО (четыре орбитали атома $C$ и четыре орбитали четырех атомов $H$).
-
Построение МО
В молекуле $CH_4$ образуеться восемь МО. Напомним, что число МО всегда равно числу исходных АО.
-
Построение связывающих МО
В молекуле $CH_4$ четыре связывающих МО. Число связывающих МО равно числу АО того партнера, у которого их меньше. В данном случае число АО центрального атома равно числу АО лигандов, по четыре.
-
Построение антисвязывающих МО
В молекуле $CH_4$ четыре антисвязывающих МО. Число антисвязывающих МО равно числу связывающих.
У лигандов все АО одинаковы ($1s$), а у центрального атома их два вида ($2s$ и $2p$). Поэтому образовалось два типа МО --- одна, обусловленная перекрыванием орбиталей лигандов с единственной $2s$-АО атома С, и три -- с тремя $2p$-АО атома $C$.
-
Построение несвязывающих МО
В молекуле $CH_4$ нет несвязывающих МО.
-
Заполнение МО электронами.
Как и в атоме, заполнение орбиталей происходит снизу вверх, на одной орбитали находится не более двух электронов, при наличии МО с одинаковой энергией заполняется их максимальное число.
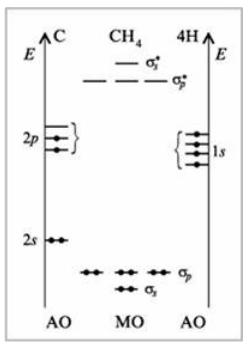
Рисунок 3. Энергетическая диаграмма молекулы CH4
Мы видим, что в молекуле метана в соответствии с результатом метода МО электроны располагаются на двух энергетических уровнях, что подтверждается экспериментом. Это не значит, что в молекуле $CH_4$ электроны обладают разной энергией. Примирить одинаковость состояния всех электронов в молекуле $CH_4$ с наличием двух энергетических уровней можно, если представить себе, что каждый из восьми электронов $1/4$ времени проводит на $s$-уровне и $3/4$ времени на $p$-уровне.
Геометрия молекулы СН4 и ее связь с геометрией МО
Теперь ответим на вопрос, какова геометрия молекулы, т.е. каковы углы $H-C-H$ между связями $C-H$.
Мы видим, что вокруг центрального атома имеется четыре максимума электронной плотности (в соответствии с существованием четырех $\sigma $-связей). Их взаимодействие между собой выражается в отталкивании одноименных зарядов. Они будут располагаться в пространстве максимально далеко друг от друга. При этом, поскольку все лиганды одинаковы, расположение будет симметрично. Эти требования выполняются, если названные максимумы электронной плотности (и лиганды соответственно) будут направлены к углам правильного тетраэдра. Говорят, что угол между связями в таких молекулах тетраэдрический, равный $109^\circ 28'$ (рис. 4).
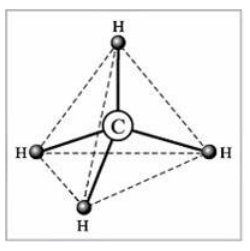
Рисунок 4. Геометрия молекулы СН4
В локализованной $sp^3$-модели орбитали метана выглядят следующим образом.
Четыре связывающие орбитали равной энергии:
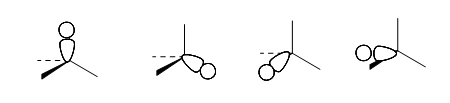
Рисунок 5.
Четыре антисвязывающие орбитали равной энергии:
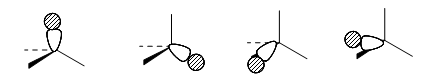
Рисунок 6.











