В случае гомоядерных молекул мы проводили комбинацию $AO$, пользуясь правилом, согласно которому наиболее сильно взаимодействуют орбитали одинаковой энергии. В гетероядерных молекулах типа $AB$ энергетические уровни атомов $A$ и $B$ неодинаковы, поэтому трудно однозначно утверждать, какие орбитали будут комбинироваться. Для случая $LiH$ это показано на рис. 1.
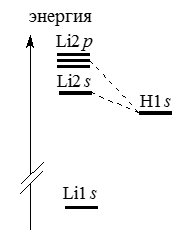
Рисунок 1. Энергетические уровни $АО$, $Li$ и $Н$
Представлены многоатомные химические частицы (молекулы, радикалы, ионы) с общей молекулярной формулой $B_n$, содержащие один центральный атом $A$, два или более концевых атома $B$ и, как следствие, только связи $A-B \sigma $.
Геометрическая форма частиц $AB_n$ выведена из метода валентных связей, т. е. из стереохимического расположения осей валентных гибридных орбиталей центрального атома $A$, и следовательно, $\sigma $-связей $A-B$.
Гибридные орбитали помогают понять пространственное строение молекул, например, почему молекула воды имеет угловую, аммиака - пирамидальную, а метана - тетраэдрическую конфигурацию.
Рассмотрение связи гибридизации и формы молекул
Гидрид бериллия, $BeH_2$, имеет линейную структуру. Для построения его локализованных связывающих молекулярных орбиталей сначала образутся две эквивалентные валентные орбитали атома $Be$, направленные к двум атомам водорода, $H_a$ и $H_b$ соответственно. Это осуществляется путем гибридизации, или смешения (составления линейной комбинации), $2s-$ и $2p$-орбиталей $Вe$, в результате чего получаются две эквивалентные «$sp$- гибридные» орбитали. Одна из этих гибридных орбиталей, $sp_a$, направлена к атому $H_a$ и сильно перекрывается с $1s_a$-орбиталью. Другая гибридная орбиталь, $sp_b$, направлена к атому $H_b$ и сильно перекрывается с $1s_b$-орбиталью. При такой схеме рассуждений две связывающие молекулярные орбитали $BeH_2$ получают путем построения двух эквивалентных линейных комбинаций, каждая из которых локализована между двумя атомами:
$sp_a+1s_a$
$sp_b+1s_b$
Эти локализованные молекулярные орбитали показаны на рис. 2. На них располагаются четыре валентных электрона, образующих две локализованные связывающие электронные пары, в согласии с льюисовой структурой связи для $BeH_2$. Каждая из линейных $sр$-гибридных орбиталей имеет наполовину $р$-характер и наполовину $s$-характер, а две $sр$-орбитали позволяют центральному атому $Be$ в $BeH_2$ присоединять к себе два атома водорода.
Теперь рассмотрим молекулу $BH_3$ (которая наблюдается при масс-спектрометрических экспериментах и представляет собой фрагмент молекулы $B_2H_6$). В этой молекуле к центральному атому бора присоединены три атома водорода. Согласно теории локализованных молекулярных орбиталей, связь в этой молекуле осуществляется в результате гибридизации $2s$-орбитали и двух $2p$-орбиталей атома бора с образованием трех эквивалентных $sp^2$-гибридных орбиталей. Каждая гибридная орбиталь имеет на одну треть $s$-характер и на две трети $p$-характер. Поскольку любые две $p$-орбитали лежат в одной плоскости, а $s$-орбиталь не имеет пространственной направленности, три $sp^2$-ги- бридные орбитали лежат в одной плоскости. Эти три $sp^2$-гибридные орбитали, перекрываясь с тремя водородными $1s$-орбиталями, образуют три эквивалентные локализованные связывающие орбитали. Каждая из таких связывающих $(sp^2+1s)$-орбиталей занята в молекуле $BH_3$ парой электронов, как это схематически показано на рис. 4. На основании представления о гибридных орбиталях можно предсказать, что молекула $BH_3$ должна иметь плоскую тригональную структуру. Угол между межъядерными осями $H-B-H$, называемый валентным углом $H-B-H$, должен составлять $120^\circ$.
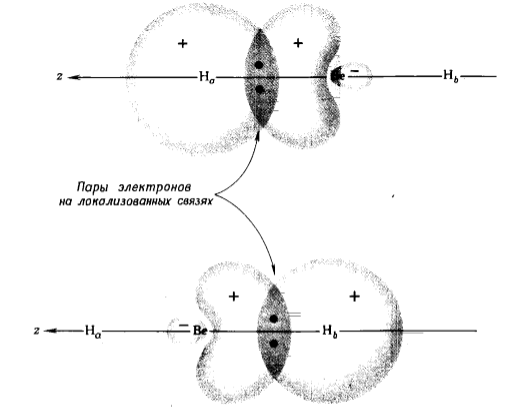
Рисунок 2. Связывающие пары электронов на локализованных связях молекулы $BeH_2$, образованных с участием эквивалентных гибридных $sp$-орбиталей атома $Be$. Каждая $sр$-орбиталь $Вe$ образует локализованную связывающую молекулярную орбиталь с $1s$-орбиталью атома водорода
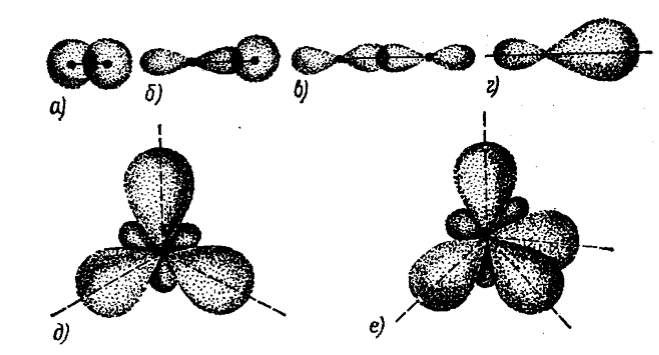
Рисунок 3. Взаимное перекрывание орбиталей. Гибридные орбитали: а - перекрывание $s$-орбиталей; б - перекрывание $s-$ орбиталей; в - перекрывание $p-$ орбиталей; г - $р$-гибридная орбиталь; д - $sp^2$-гибридные орбитали; е - $sp^3$-гибридные орбитали
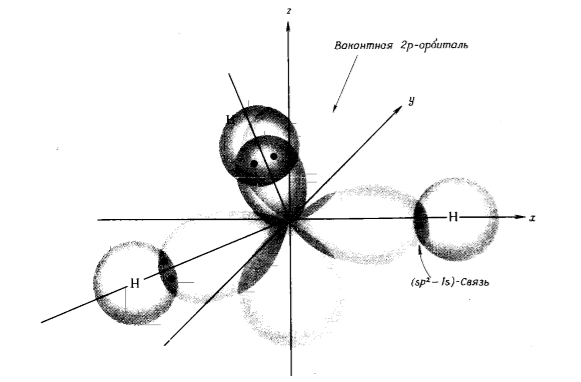
Рисунок 4. Электронные пары, обобществляемые на локализованных связях в $BH_3$
Метан, $CH_4$, имеет четыре эквивалентных атома водорода, присоединенных к центральному атому углерода. Для соединения с четырьмя атомами водорода углероду приходится использовать все свои валентные орбитали. Путем гибридизации одной $2s-$ и трех $2p$-орбиталей можно получить четыре эквивалентные $sp^3$-гибридные орбитали. Каждая $sp^3$-гибридная орбиталь имеет на одну четверть $s$-характер и на три четверти $p$-характер. Все четыре $sp^3$-орбитали направлены к вершинам правильного тетраэдра, поэтому $sp^3$-орбитали иногда называют тетраэдрическими гибридами. В результате перекрывания каждой $sp^3$-гибридной орбитали с $1s-$ орбиталью атома водорода образуются четыре локализованные связывающие орбитали. Наилучшее перекрывание между $sp^3$- и $1s$-орбиталями получается при помещении четырех атомов водорода в вершины правильного тетраэдра, как это показано на рис. 5 (где изображен куб, чередующиеся вершины которого образуют вершины упоминаемого тетраэдра). В молекуле метана восемь валентных электронов (четыре от атома углерода и по одному от каждого из четырех атомов водорода), которые должны быть размещены на четырех локализованных связывающих орбиталях. Эти восемь электронов образуют четыре эквивалентные локализованные связывающие электронные пары, схематически показанные на рис. 5.
Структуру молекулы $CH_4$ определяли различными экспериментальными методами. Все полученные данные приводят к выводу о тетраэдрическом строении молекулы $CH_4$ (рис. 6), в полном согласии с предсказаниями теории локализованных молекулярных орбиталей. Валентный угол $H-C-H$ равен $109,5^\circ$, а длина связи $C-H$ составляет $1,093 A$.
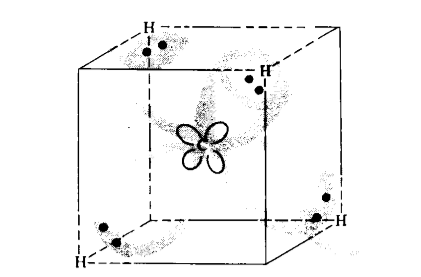
Рисунок 5. Электронные пары, обобществляемые на локализованных связях в $СН_4$
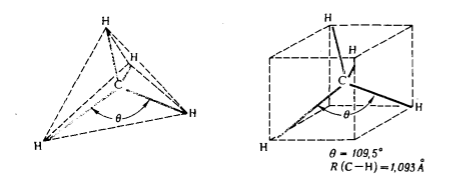
Рисунок 6. Тетраэдрическая молекулярная структура $СН_4$












