Понятие гиперконъюгации
Гиперконъюгация -- это взаимодействие $s$-электронов связей $C-H$ с $\pi $-электронной системой кратных связей в органической молекуле, т. е. это сопряжение между простыми и кратными связями. Примером органического заместителя, способного проявлять эффект сверхсопряжения, является метильная группа, обладающая положительным мезомерным эффектом, хотя она и не содержащая неподеленных пар электронов (рис. 1).
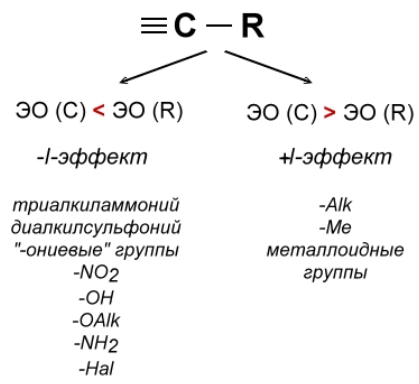
В целом алкильные группы характеризуются очень небольшим положительным индуктивным эффектом, т.е. лишь слегка отталкивают электроны. Индуктивный эффект алкильных групп увеличивается в ряду:
$CH_3
В этом же ряду увеличивается и относительная стабильность алкильных катионов. Напри-мер, повышенная стабильность этильного катиона по срав-нению с метильным объясняется перекрыванием свободной $p$-орбитали с $s$-орбиталями $C-H$-связей соседней метильной группы. Этот эффект в еще большей степени проявляется в случае трет-бутильного катиона, где имеются три метильные группы, стабилизирующие положительный заряд карбокатиона за счет делокализации электронного облака. На письме явление гиперконъюгации обозначают с помощью изогнутых стрелок (рис. 2):
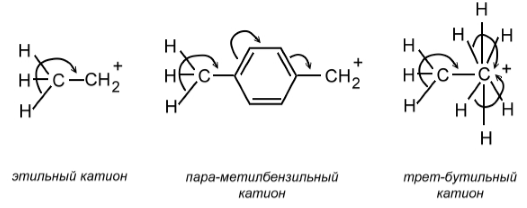
Рисунок 2. Гиперконъюгация
Приведенные на рис. 2 формулы означают, что $s$-электроны связей $C-H$ частично смещаются на вакантные $\pi $- или $p$-орбитали. Способность $s$-электронов к такому взаимодействию зависит от конкретного типа $\sigma $-связи:
-
явление гиперконъюгации не проявляется в случае $\sigma $-связей $C-C$ (трет-бутильная группа);
-
заметно в случае $\sigma $-связей $C-H$;
-
очень сильно проявляется в случае $\sigma $-связей $C$-металл в металлоорганических соединениях.
Наряду с термином «гиперконъюгация» в литературе часто используется термин «$\sigma $-$\pi $-сопряжение».
Влияние явления сверхсопряжения на характеристики органических соединений
Эффект гиперконъюгации проявляется, в частности, в величинах дипольных моментов органических молекул. Например, если попытаться вычислить дипольный момент масляного альдегида (бутаналя) по правилу векторной аддитивности исходя из дипольных моментов пропионового альдегида (пропаналя) и пропана, то получится величина $2,544$ Д. В то же время, величина дипольного момента бутаналя, определенная экспериментально, составляет $2,57$ Д. То есть разница между рассчитанным и экспериментальным значением составляет всего $0,03$ Д (рис. 3).
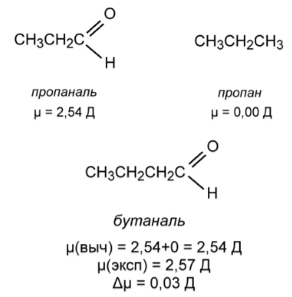
Рисунок 3. Дипольный момент масляного альдегида
Однако если аналогичным образом вычислить дипольный момент кротонового альдегида (пропилен-1-карбальдегида) (рис. 4), исходя из дипольных моментов акролеина (пропеналя) и пропилена, различие между полученным значением ($3,26$ Д) и экспериментально определенной величиной ($3,67$ Д) составит уже $0,4$ Д. Отсюда следует, что метильная группа взаимодействует с группой $-CH=O$ через $\pi $-систему ($-CH=CH-$)гораздо сильнее, чем через $\sigma $-связь ($-CH_2-CH_2-$). То есть налицо явление гиперконъюгации.
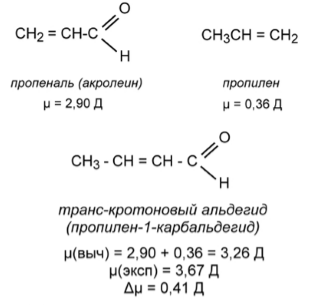
Рисунок 4. Дипольный момент кротонового альдегида
Если существуют положительные и отрицательные индуктивные и мезомерные эффекты, то логично предположить и существование отрицательного эффекта сверхсопряжения. Например, для трифторметильной группы в пара-положении трифторметилфенолят-аниона (рис. 5) однако строгие экспериментальные доказательства отрицательной гиперконъюгации отсутствуют.
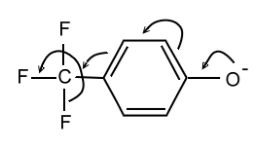
Рисунок 5. Отрицательная гиперконъюгация
Простейшим примером сверхсопряжения является молекула пропилена (рис.6). В данном случае смещение $\pi $-электронной пары связано и смещение $\sigma $-электронов связей $C-H$ метильной группы происходит в одном и том же направлении. Отсюда следует, что атомы водорода метильной группы будут легко отщепляться в виде протонов, что может быть проиллюстрировано на примере взимодействия пропилена с формальдегидом (рис. 7).
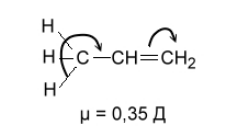
Рисунок 6. Гиперконъюгация в молекуле пропилена
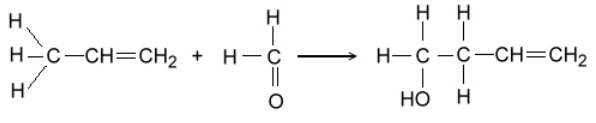
Рисунок 7. Реакция альдольной конденсации
В системах, содержащих связь $C=O$ явление сверхсопряжения выражено еще ярче из-за более высокой электроотрицательности атома кислорода по сравнению с атомом углерода. Характерным примером является повышенная реакционная способность атомов водорода, связанных с $\alpha $-углеродным атомом в молекулах альдегидов, кетонов и сложных эфиров. Однако, если этот атом водорода заменить на более поляризуемый атом (например, на атом ртути), то в ходе химических реакций таких соединений будет иметь место разрыв связи $C=O$, а не $Hg-C$.












