Если в молекуле этилена заменить один атом водорода на атом фтора, то получим новое вещество - фторэтилен FCH=CH2 (винилфторид).
Свойства фторэтилена
Фторэтилен -- при обычной температуре и атмосферном давлении является бесцветным газом со специфическим запахом.
Фторэтилен кипит при $-72^\circ \ C$, замерзает при $-160^\circ \ C$. Получают винилфторид подобно винилхлориду, из ацетилена и фтороводорода (в соотношении $1: 1,5$) в присутствии хлорида ртути:
$CH_2=CH_2 + HF =FCH=CH_2$
Фторэтилен нашел широкое применение в реакциях полимеризации, но в отличие от винилхлорида спонтанно не полимеризуется. Его активность в полимеризации меньше, чем у этилена и полимеризуется он в подобных для этилена условиях при давлении до $2000$ атм и в присутствии пероксидных инициаторов или редоксисистем.
Плотность поливинилфторида (фторопласта-1) - полимера получаемого из фторэтилена - $1,39$ г/мл, т. пл. $198^\circ \ C$, т. хрупкости $-180^\circ \ C$. Молекулярная масса $28000-50000$. При температурах ниже $110^\circ \ C$ фторопласт-1 не растворяется в органических растворителях. Поливинилфторид сильно поглощает в ИК диапазоне (в интервале $770-1430 \ см^{-1}$). В его полимерной цепи заметное количество аномальных соединений типа ''голова-голова '' и "хвост-хвост". Наиболее цинные изделия фторопласта-1 - гибкие и прозрачные в видимом и УФ-диапазоне пленки: с коэффициентом преломления $1,45$. Такие пленки остаются прозрачными и гибкими при любых погодных условиях до $20$ лет. Поливинилфторид применяются как антикоррозионные покрытия алюминиевых и оцинкованных стальных листов.
$\pi$-Система фторэтилена
Молекулы фторэтилена $FCH=CH_2$ имеют $\pi$-системы, аналогичные $\pi$-системам енолят-анионов альдегидов. Поэтому небольшые положительные мезомерные эффекты атомов фтора ($\delta+=-0,07$) будут увеличивать $\pi$-электронные плотности в атомах $C(2)$. $\pi$-Электронные плотности концентрируются в основном на атомах фтора и $b$-углеродных атомах аллильной группы, но наивысшые $\pi$-электронные плотности остаются все-таки у атомов фтора:
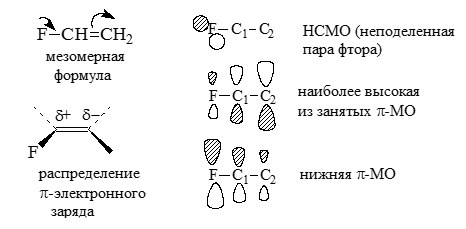
Рисунок 1.
Поскольку $\pi$-электронные заряды наиболее велики на атомах $F$ и у атомов $C(2)$ больше, чем у атомов $C(1)$, $\pi$-составляющие дипольных моментов молекул фторэтилена, если их рассматривать как векторные суммы $\pi$-составляющих диполей связей $C-C$, а также $C-F$, будут направлены от атомов фтора к атомам углерода (т.е. атомы фтора будут отрицательными концами диполей):
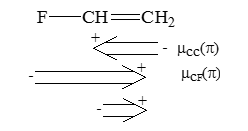
Рисунок 2.
Отсюда следует, что направления изогнутых стрелок в мезомерных формулах как фторэтилена, так и других молекул нельзя приравневать с направлениями $\pi$-составляющих дипольных моментов молекул. Стрелки дают представления лишь о распределениях электронных плотностей на высших из занятых $\pi$- молекулярных орбиталей фторэтилена. Использование стрелок помогает объяснять ориентации при электрофильном присоединения к фторэтилену, а также к другим алкенам. Но суммарные распределения $\pi$-электронов в молекулах и, следовательно, $\pi$-составляющие дипольных моментов определяются не только $\pi$-ВЗМО, но и другими занятыми $\pi$-орбиталями.
Свободнорадикальное присоединение
При присоединении катионов к олефинам в качестве граничной орбитали рассматривается только пара электронов на ВЗМО. При присоединениях радикалов к олефинам возможны два варианта взаимодействия: ОЗМО радикалов можгут играть или роль НСМО, взаимодействующих с ВЗМО олефинов, и тогда в реакциях участвуют уже три электрона, или роли ВЗМО, взаимодействующих с НСМО олефинов, и тогда в реакциях участвует только один электрон. Свободнорадикальные присоединения менее экзотермичны, чем катионные, и переходные состояния являются более поздними, т. е. переходные состояния более похожи на продукты реакции. Хотя радикалы не являются ионными частицами, но реакции свободнорадикальных присоединений зависят от относительной энергии ОЗМО и ВЗМО (рис. 3).
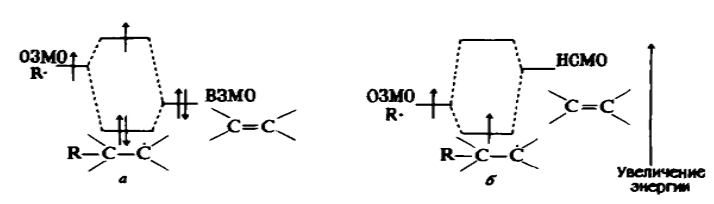
Стерические эффекты, которые играют лишь незначительную роль в реакции присоединения катиона, при свободнорадикальном присоединении к несимметричным алкенам становятся основопологающим фактором, определяющим ориентацию.
Рассмотрев реакции трифторметильного и метильного радикалов, можно сравнить реакционную способность радикалов в целом.
Метильные радикалы можно считать относительно отталкивающими электроны, а трифторметильные - притягивающими электроны. В свете приведенной выше схемы метильные радикалы проявляют характерные свойства ВЗМО-генов, а трифторметильные радикалы - НСМО-генов. Влияние полярности иллюстрируется сравнением скоростей присоединения метальных и трифторметильных радикалов к этену и тетрафторэтену. Изменение относительных скоростей достигает двух порядков величины. Однако не менее значительны могут быть и стерические эффекты. Так, трифторометильные радикалы присоединяются и к пропену, и к $3,3,3$-трифторопропену по $CH_2$ концу двойной связи, что резко контрастирует с описанными выше присоединениями к этим же олефинам катионов. Важность стерических эффектов иллюстрируется ориентациями присоединений разветвленных перфтороалкильных радикалов к винилфториду (таблица 1).
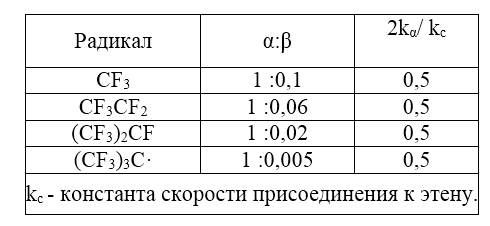
Рисунок 4. Ориентация и относительная скорость присоединения разветвленных фтороалкильных радикалов к фторэтилен $FCH=CH_2$ (в газовой фазе, $164^\circ \ C$)
Стерический эффект управляет ориентацией присоединения радикалов, тогда как полярность влияет и на ориентацию, и на относительные скорости. Эти эффекты могут быть противоположными друг другу, и в ряде случаев предпочтительная ориентация для данного алкена может обращаться при изменении атакующего радикала от метила к трифторометилу. В таких радикальных реакциях принцип «реакционная способность - селективность», согласно которому с увеличением реакционной способности селективность должна уменьшаться, уже не действует, например:
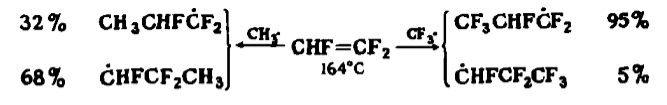
Рисунок 5.
Радикалы $CF_3$ одновременно и более реакционноспособны, и более селективны, поскольку вследствие того, что они имеют более низкие ОЗМО, переходное состояние более полярно.












