
Внутримолекулярные взаимодействия
Под внутримолекулярным взаимодействием понимают различные виды химической связи, обеспечивающие существование многоатомных соединений (ионов, молекул, кристаллических веществ и др.). Химическая связь - это физико - химическое явление взаимодействия атомов, при котором перекрываются электронные облака связывающихся частиц и уменьшается энергия системы. Химическая связь представляет собой силу, которая удерживает атомы вместе и позволяет им функционировать вместе как единой группе.
Стабильность группы атомов, объединённых химической связью, определяется тем, насколько удалось понизить энергию по сравнению с отдельными атомами. Чем больше при образовании химической связи выделяется энергии, тем прочнее связь.
Энергетический уровень многоатомной системы определяется балансом сил отталкивания между одинаково заряженными частицами и сил притяжения между частицами с зарядами разного знака.
Наибольший вклад в образование химической связи вносят электроны внешних оболочек атомов.
Химическая связь характеризуется:
-
снижением общей энергии системы по сравнению с суммарной энергией изолированных частиц, образующих эту систему;
-
перераспределением электронных плотностей в местах образования химических связей;
-
взаимодействием между положительно заряженными ядрами атомов и отрицательно заряженными электронами.
Виды химической связи
Существует несколько видов химической связи. Природа их возникновения объясняется тем, что связь между ионами или атомами в молекулах или конденсированных фазах сводится к электростатическим взаимодействиям. При этом распределение электронного заряда между атомами при образовании связи можно предсказать только с учетом законов квантовой механики.
Виды химической связи:
-
Ковалентная связь. Это связь, образованная в результате обобществления электронных пар двумя атомами. Ковалентная связь характерна абсолютному большинству неорганических и органических соединений.
Разновидностью ковалентной связи является донорно - акцепторная связь. При ней один атом представляет для образования связи пару электронов, другой атом ее принимает. Результатом взаимодействия является общая электронная пара.
-
Ионная связь. Это связь, обуславливающая электростатическое взаимодействие катионов и анионов в соединении. Возникает, если значение электроотрицательности атомов сильно отличаются. Ионная связь ненаправлена и ненасыщаема.
Например: ионная связь возникает между катионами $s$- металлов I и II групп периодической системы и анионами неметаллов VI и VII групп ($LiF, CsCl, K_2O$ и др.).
Не существует «идеальной» ионной связи. Можно говорить лишь о большей или меньшей ионности (доля ионности).
-
Металлическая связь. Характерна только для конденсированного состояния вещества. Это многоцентровая связь с дефицитом электронов в твердом или жидком веществе, основанная на обобществлении внешних электронов атомов.
-
Внутримолекулярные водородные связи. Возникают в одной молекуле между атомами водорода и отрицательными атомами полярных групп. Для образования внутримолекулярных водородных связей в молекуле должны быть атомы водорода $Н$ с выраженным положительным зарядом +$\delta $ (группы $- O$ $-H$) и электродонорные атомы (например, $=O$). Например: На Рис. 1 изображены орто- нитрофенол (а) и салициловый альдегид (б), имеющие водородные связи (обозначены пунктиром) между водородом групп $-O -H$ и кислородом других групп.
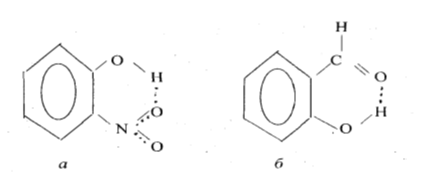
Рисунок 1.
Молекулы, имеющие внутримолекулярные водородные связи, не могут образовывать межмолекулярные водородные связи.
Величины, характеризующие химическую связь:
-
Энергия связи $Е_{св}$. Это количество энергии, выделяющееся при образовании связи, измеряется в кДж/моль. Служит мерой прочности химической связи. Величина энергии связи определяется работой, затраченной на разрушение связи или выигрышем в энергии при образовании вещества из отдельных атомов. Средняя энергия связи для многоатомных соединений определяется делением энергии образования соединения из отдельных атомов на число связей.
-
Длина связи $l_{св}$. Равна расстоянию между ядрами атомов в соединении. Зависит от размеров электронных оболочек, степени их перекрывания. Между энергией связи и ее длиной существует зависимость: чем меньше длина связи, тем выше энергия и соответственно устойчивость молекулы.
Например: в ряду галогеноводородов длина связи от $HF$ до $HI$ растет, а энергия уменьшается.
-
Валентные углы зависят от природы атомов и характера химической связи.
Межмолекулярные взаимодействия
Электрически нейтральные атомы и молекулы, валентно -- насыщенные, способны к дополнительному взаимодействию друг с другом. Степень проявляемого при этом взаимодействия может меняться в широких пределах.
Силы межмолекулярного взаимодействия можно сопоставить по величине энергии с ионными и ковалентными связями. Значения соответствующих значений энергии приведены ниже:
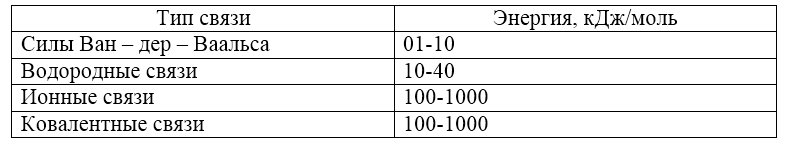
Рисунок 2.
По сравнению с другими видами химической связи, межмолекулярные силы самые слабые. Но их влияние на свойства веществ довольно значительно, а в ряде случаев межмолекулярные силы полностью определяют состояние вещества.
Основные виды межмолекулярного взаимодействия:
-
Ван - дер - ваальсовы силы. Силы электростатической природы.
-
Водородные связи. Имеют промежуточный характер между валентным и межмолекулярным взаимодействием. Водородная связь осуществляется между положительно поляризованным атомом водорода одной молекулы, и отрицательно поляризованным атомом (чаще это фтор, кислород, азот, реже -- хлор, сера и др.) другой молекулы.
-
Донорно -- акцепторное взаимодействие. Возникает при наличии у атомов одной из молекул свободной орбитали, а у атомов другой молекулы -- электронной пары. Данный тип взаимодействия возможен как между одинаковыми, так и между разными молекулами.











