Согласно с теорией граничных орбиталей, основной фактор, определяющий реакционные способности реагентов в реакциях электрофильного замещения, это взаимодействия ВЗМО аренов и НСМО электрофилов. Соответственно чем меньше энергетические щели между ВЗМО аренов и НСМО электрофилов, тем более прочными будут первоначальные донорно-акцепторные комплексы между $ArH$ и $E^+$, что в свою очередь способствует их переходам в аренониевые ионы и далее в продукты реакции. Место внедрения новых заместителей должно определяться относительными вкладами $p-AO$ атомов углерода в бензольном кольце в ВЗМО. Эти вклады (их расчетные коэффициенты) можно вычислить квантовомеханическими методами. Квадраты коэффициентов характеризуют электронные плотности на данных атомах в данных орбиталях (ВЗМО).
Распределение электронных плотностей
На схеме ниже показаны структуры с распределением электронных плотностей на ВЗМО в феноле, анилине и тиофеноле, которые были вычисленные при помощи неэмпирических методов:
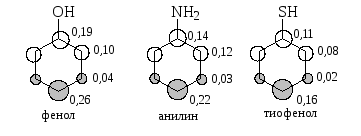
Во всех этих молекулах плотности ВЗМО изменяются в последовательности мета-
Как правило все таки необходимо учитывать все типы взаимодействий: орбитальные, силы которых зависят от коэффициентов, с которыми данные атомы входят в граничные орбитали, и кулоновские, силы которых зависят от зарядов на данных атомах.
Гидроксилирование толуола и фторбензола
Примером таких перегруппировок является ориентация в реакции электрофильного гидроксилирования толуола (по В. А. Коптюгу, 1981). Эта реакция происходит в суперкислой среде, где катионы $OH^+$ (электрофильные агенты) достаточно устойчивы и получаются воздействием фторсульфоновой кислоты и пероксида водорода:
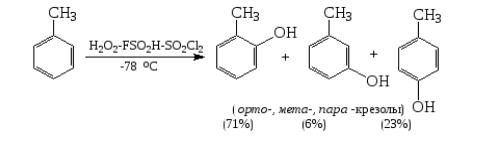
Как показано на схеме реакции, в данном случае очень высок выход орто-продукта. В реакции гидроксилирования фторбензола выход орто-фторфенола в три раза меньше выхода пара- фторфенола:
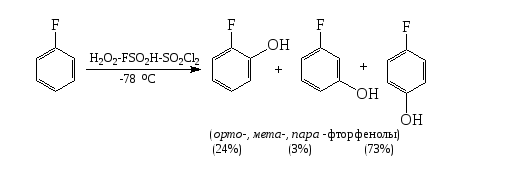
Этот процесс не согласуется с теоретическим распределением электронных плотностей на ВЗМО, которые для толуола и фторбензола практически одинаковы, с наибольшими коэффициентами в ипсо- и пара- положении. Процесс гидроксилирования фторбензола идет в соответствии с распределением электронной плотности на ВЗМО по ряду мета-
Объяснение расхождения в ориентациях замещения в фторбензоле и толуоле
Чтобы объяснить наблюдающиеся расхождения в ориентациях между фторбензолом и толуолом, которые имеют близкую картину распределения электронных плотностей на ВЗМО, необходимо принять, что атаки электрофилов происходят не «на атом», а «на π-связи» между данными парами атомов. Например, для замещения по орто-положению:
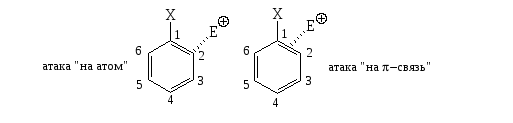
- при атаках «на атом» важны коэффициенты атомом $C(2)$ в ВЗМО
- при атаках «на π-связи» – суммы коэффициентов $C(2)$ и $C(1)$.
Так суммарный процесс гидроксилирования толуола можно изобразить следующей схемой:
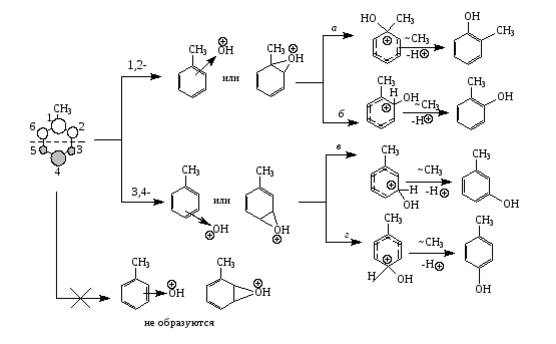
Поскольку ВЗМО тулоуола имеют узлы в зоне связей $C(2)-C(3)$ (или $C(5)-C(6))$, образованием $2,3$-интермедиатов можно пренебречь. Значит, мета- и пара- продукты образовываются через $3,4$-интермедиаты (пути в и г). Перегруппировка ипсо-комплексов (путь а) дает дополнительный выход орто-крезола в $12\%$. Это доказано опытами с толуолом содержащем меченный изотоп $13C$:
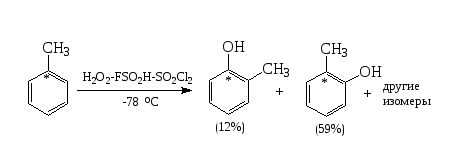
Следовательно, 59% орто-изомера образуется по пути б, т.е. связано с орбительными коэффициентами и зарядами на атомах связей $C(1)-C(2) (C(1)-C(6))$ и $C(3)-C(4) (C(4)-C(5))$, а также с относительной термодинамической устойчивостью изомерных $\sigma$-комплексов.











