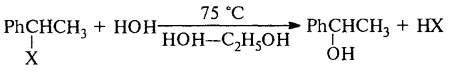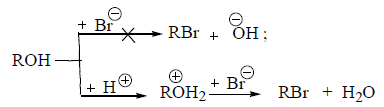Нуклеофугность уходящей группы
При $SN2$- и $SN1$-механизмах уходящая группа $Z$ отщепляется вместе со связывающей электронной парой. Поэтому происходит корреляция между стабильностью аниона $Z^-$ и скоростью реакции.
Иногда, для узких серий родственных уходящих групп между кислотностью $HZ$ и реакционной способностью существует количественная зависимость ($Z^-=XC_6H_4SO+3^-).$
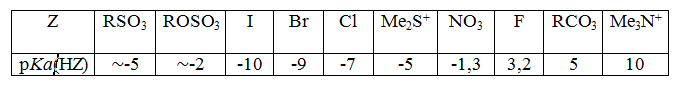
Для большинства уходящих групп при сравнении их нуклеофугности с $pKa(HZ)$ в водных растворах существует последовательность:
$RSO_3≈ ROSO_3 > I > Br > Cl > Me_2S^+ > NO_3 > F > RCO_3 > Me3N^+$
Нуклеофугность связана с основностью, влиянием растворителя.
Влияние природы уходящей группы на скорость нуклеофильного замещения
На скорость нуклеофильного замещения оказывает влияние природа уходящей группы. Сольволиз 1-фенилгалогенида и 1-фенилэтиловых эфиров в 80% водном этаноле при 75ºС имеет вид:
Реакционная способность нуклеофугов изменяется параллельно их электроотрицательности:
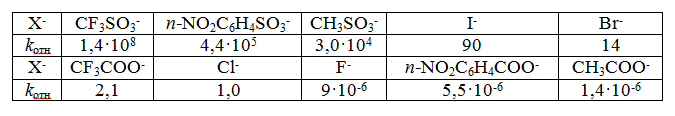
$CF_3COO^- ≫ CH_3COO^-$; $n-O_2NC_6H_4SO_3^- > n-CH_3C_6H_4SO_3^-.$
Относительная «активность» галогенид-ионов уменьшается в ряду $I^- > Br^- > Cl^-$
Электроотрицательность при этом изменяется в противоположном направлении: $F > Cl > Br > I. $
Нуклеофугность сульфонатов $RSO_3^-$ намного выше нуклеофугности галогенид-ионов и карбоксилат-ионов. Сульфонаты первичных и вторичных спиртов получают в результате взаимодействия эквимольных количеств спирта и сульфохлорида в растворе в пиридине при 0-5ºС.
Наилучшей уходящей группой среди сульфонатов является трифлат $CF_3SO_3^-$ (трифторметансульфонат). По своей нуклеофугности трифлат намного превосходит сульфонат тозилат $n-CH_3C_6H_4SO_3^-.$
Скорость ацетолиза у циклопропилтрифлата в 100 000 раз выше, чем у циклопропилтозилата при одинаковых условиях.
Влияние уходящей группы на реакции, протекающие по SN2- и SN1-механизмам
Сильная уходящая группа способствует более глубокой ионизации и в переходном состоянии реакции замещения $SN1$-типа связь $C-Z$ разрывается в большей степени, чем в реакциях $SN2$. Для замещения слабой уходящей группы необходим более сильный нуклеофил.
Реакцию можно ускорить модификацией уходящей группы.
Аклкилфториды в обычных условиях инертны к действию нуклеофилов, но в растворах серной кислоты $H_2SP_4$ они гидролизуются. Уходящей группой является $HF$, а не $F^-.$
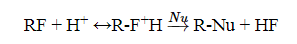
Подобным образом в кислых средах расщепляются простые эфиры
В нитрометане трет-бутилбромид взаимодействуе с нуклеофилами $Cl^-$, $Br^-$, $NO_2^-$, $EtOH$, $H_2O$, $PhOH$, с низкой концентрацией почти с одинаковой скоростью, по первому кинетическому порядку ($SN1$-реакция).
При высоких концентрациях гидроксилсодержащих нуклеофилов ($EtOH$, $H_2O$, $PhOH$) наблюдается второй порядок. Скорость реакции пропорциональна кислотности этих реагентов, сила которых изменяется в противоположном ряду в сравнении с рядом нуклеофильности. Медленной стадией этого $SN1$-процесса является ионизация, но при больших концентрациях $ROH$ отщепление бромид-иона катализируется образованием водородной связи:
$t-Bu-Br + HOR ↔ t-Bu-Br…H-OR ↔ [t-Bu^+….Br^-….H-OR] →t-BuOR + HBr$
Этот катализ может осуществляться молекулами протонного растворителя, его результатом является частичное сглаживание реакционной способности алкилгалогенидов, так как способность к образованию водородной связи уменьшается в ряду: $F > Cl > Br > I$, а нуклеофильность – в противоположном направлении.
Например: При взаимодействии $CH_3X$ с азид-ионом в ДМФА при 25ºС соотношение скоростей для $X=Cl$, $Br$, $I$ составляет 1:25:2000, а в метаноле 1:60:100.
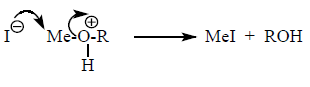
Такие группы как –$OH$, -$OR$, -$NH_2$, обычно не могут замещаться сразу другими нуклеофилами. Замещение возможно после модификации уходящей группы (например, ее протонирования), когда она станет слабым основанием.
Например: Группу –$OH^-$ нельзя непосредственно заместить бромид-ионом $Br^-$. Но замещение станет возможным, если ему предшествует протонирование:
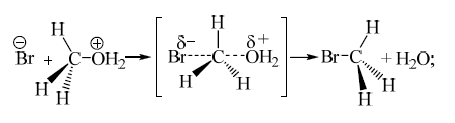
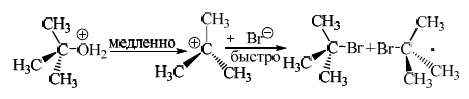
В зависимости от строения радикала взаимодействие нуклеофила с протонированным спиртом осуществляется по механизму $SN1$ или $SN2$:
Если заменить уходящую группу, то изменится скорость как $SN1$-, так и $SN2$-реакции, так как разрыв связи с уходящей группой происходит на медленной лимитирующей стадии.
Относительная способность частицы $X$ в соединении $R-X$ быть уходящей группой определяется:
- прочностью связи $R-X$;
- поляризуемостью связи $R-X$;
- стабильностью иона $X$-;
- степенью стабилизации посредством сольватации образующегося иона $X$- в переходных состояниях как $SN1$-, так и $SN2$-механизма.
Чем более сильным основанием будет уходящая группа, тем труднее она замещается.