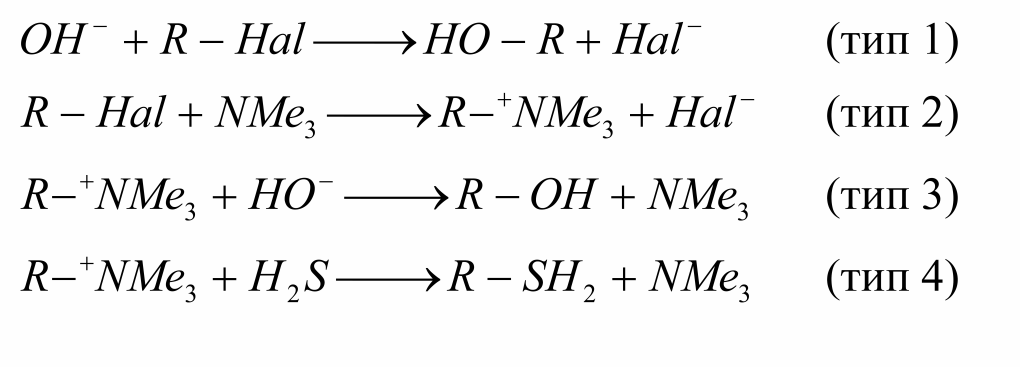Вопрос о влиянии природы нуклеофильных реагентов и уходящих групп $Z$ в $RZ$ на скорость $SN_2$-реакции нельзя рассматривать, не принимая во внимание природу растворителя, в котором проводится реакция. «Собственная нуклеофильность» нуклеофильных реагентов $Nu:$, так же как и «собственная нуклеофугность» уходящих групп $Z:$, проявляется только при проведении реакций между $Nu:$ и $CH_3Z$ в газовой фазе. В настоящее время скорость газофазной реакции нуклеофильного замещения можно из-мерить, например, методами ионного циклотронного резонанса (ИЦР) или послесвечения в потоке. Эти данные представляют большую ценность для изучения влияния сольватации.
Влияние структуры субстрата
Разветвления в $α-$ и $β-$положениях для реакций, протекающих по механизму $SN_2$ снижают их скорость. Третичные соединения практически не реагируют по механизму $SN_2$, а неопентильные системы реагируют так медленно, что такие реакции не имеют синтетической ценности. Приведем относительные значения скоростей реакции ($V$) для алкильных субстратов ($R$) по механизму $SN_2$ (скорость реакции для этила принята за еденицу).
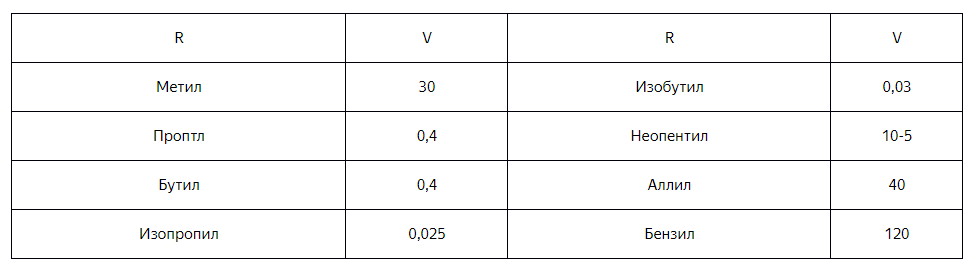
Низкие скорости обусловлены стерическими факторами. Переходное состояние более перегружено, когда у центрального атома находятся объемные группы. По аналогичной причине замедляется или совсем не идет замещение по механизму $SN_2$ у атома углерода карбонильной группы при разветвлении в $α$- и $β$-положениях.
Это можно объяснить порядком стабильности алкильных катионов (третичный > вторичный > первичный). Разумеется, скорость зависит не от стабильности самих ионов, а от разницы свободной энергии между исходными соединениями и переходными состояниями.
Таким образом, можно сделать вывод, что первичные и вторичные субстраты преимущественно реагируют по механизму $SN_2$, а третичные по $SN_1.$ Но третичные субстраты редко вступают в реакции нуклеофильного замещения вообще. В качестве побочной реакции при нуклеофильном замещении всегда возможно отщепление (когда в $β$-положении есть. водород), а в случае третичных субстратов оно обычно преобладает. За редким случаем нуклеофильное замещение у третичного атома углерода не может дать хороших препаративных результатов.
Ненасыщенный α-атом углерода
Субстраты винильного, ацетиленового и арильного типов характеризуются очень низкой реакционной способностью в реакциях нуклеофильного замещения. Для таких систем реакции по механизму $SN_2$ сильно замедляются или вообще не идут. Это объясняется тем, что атом углерода в состоянии $sp$ гибридизации обладает более высокой электроотрицательностью, чем атом в $sp1$ гибридизации. $SN_2$-реакции винильных субстратов могут быть ускорены введением $β$-заместителей, которые стабилизируют карбанионы. Кроме того, реакции субстратов винильного типа могут идти по механизму присоединения-отщепления и отщепление-присоединения.
В отличие от таких систем субстраты типа $RCOX$ обычно более реакционно способны, чем $RCH_2X$. Понятно, что в большинстве случаев взаимодействие этих субстратов проходит через образование тетраэдрического интермедиата.
Повышенная реакционная способность RCOX объясняется тремя причинами:
- атом углерода карбонильной группы несет значительный положительный заряд, что делает его приорететным для нуклеофилов;
- в механизме $SN_2$ на лимитирующих стадии должна разрываться $σ$-связь, что требует большей энергии, чем смещение пары $\pi$-электронов, которое проходит в тетраэдрических механизме;
- тригональный атом углерода создает меньшие стерические препятствия нуклеофилам, чем тетраэдрические.
Ненасыщенный β-атом углерода
$SN_2$-реакции замедляются в тех случаях, когда в $β$-положении есть двойная связь, поэтому алильные и бензильные субстраты реагируют медленно. Это объясняется тем, что такие катионы дестабилизированы вследствие резонанса. Скорость реакции по механизму $SN_2$ алильных субстратов замедляются еще больше при введении в положение 1 и 3 заместителей (алкильные, арильные группы, галогены), которые дестабилизируют карбокатион вследствие резонанса или гиперконьюгации.
Влияние электронодонорных и электроноакцепторных заместителей
Измеряя скорость замещения для различных соединений типа можно исследовать влияние электронных эффектов группы $Z$ в данной реакции. Как правило для реакций по механизму $SN_2$ электроноакцепторные заместители снижают скорость, а электронодонорные повышают ее. Однако для $SN_2$-реакции простых корреляций не найдены.
Природа уходящей группы
Природа уходящей группы ($X$) влияет на скорость $SN_2$ - реакции аналогично $SN_1$ - реакции. Различие только в том, что в случае бимолекулярного замещения связь $C-X$ в переходном состоянии растянута значительно меньше, чем в мономолекулярном замещении. Поэтому чувствительность к смене уходящей группы в реакциях $SN_2$ существенно меньше.
Влияние нуклеофила
Нуклеофильная реакционная способность реагента и изменение природы нуклеофила должно влиять на скорость $SN_2$ - реакции, так как он присутствует в переходном состоянии скорость определяющей стадии.
Скорость реакций по механизму $SN_2$ зависит от природы реагента так: нуклеофил, который несет отрицательный заряд, всегда сильнее своей сопряженной кислоты ($OH^-$ сильнее $H_2O$) нуклеофильность примерно совпадает с порядком основности (электронодонорности) сверху в низ в группах периодической системы нуклеофильность увеличивается; чем сильнее нуклеофил, тем больше скорость.
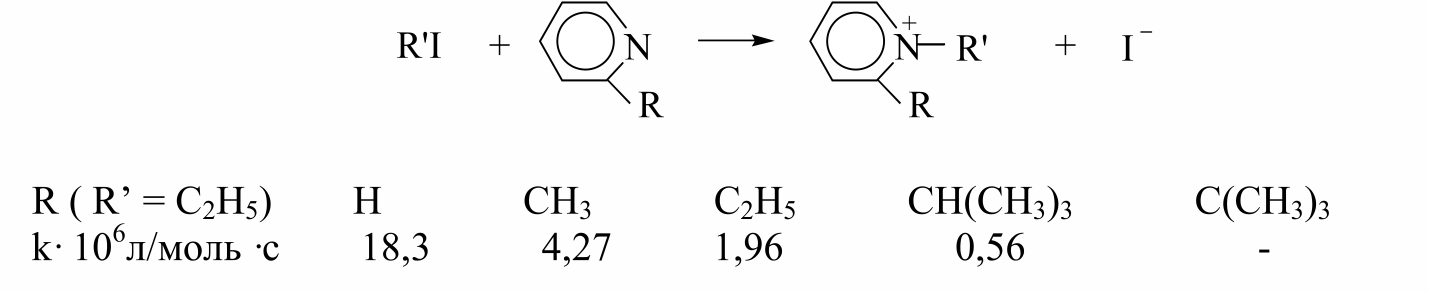
Увеличение эффективного объема нуклеофила приводит к дестабилизации переходного состояния и, следовательно, к уменьшению реакционной способности нуклеофила, а так же к замедлению $SN_2$ -замещения. Например, введение алкильных заместителей в $α$- положение в молекулу пиридина приводит к следующим изменениям скорости реакции:
Влияние реакционной среды
В реакциях $SN_2$ влияние растворителя зависит от того, к какому зарядовому типу относится реакция.
Для типа 1 и 4 начальный заряд делокализуеться в переходном состоянии, поэтому полярные растворители затрудняют реакцию. Для типа 3 в переходном состоянии начальные заряды уменьшаются, поэтому полярные растворители сильно затрудняют реакцию. И только в 2 типе реакций, в которых реагенты не заряжены, а заряд возникает в переходном состоянии, скорость возрастает в полярных растворителях.