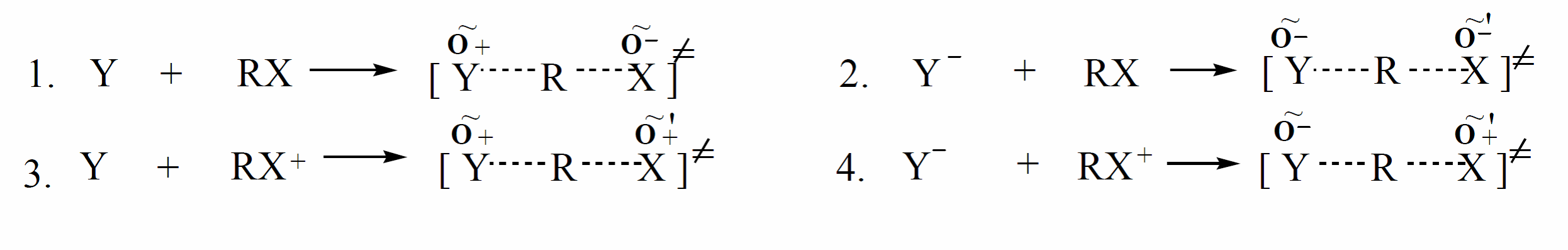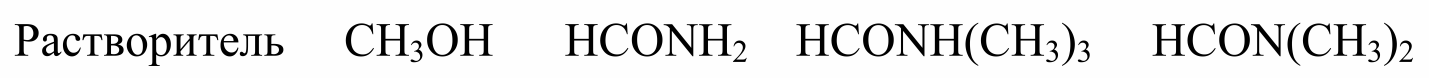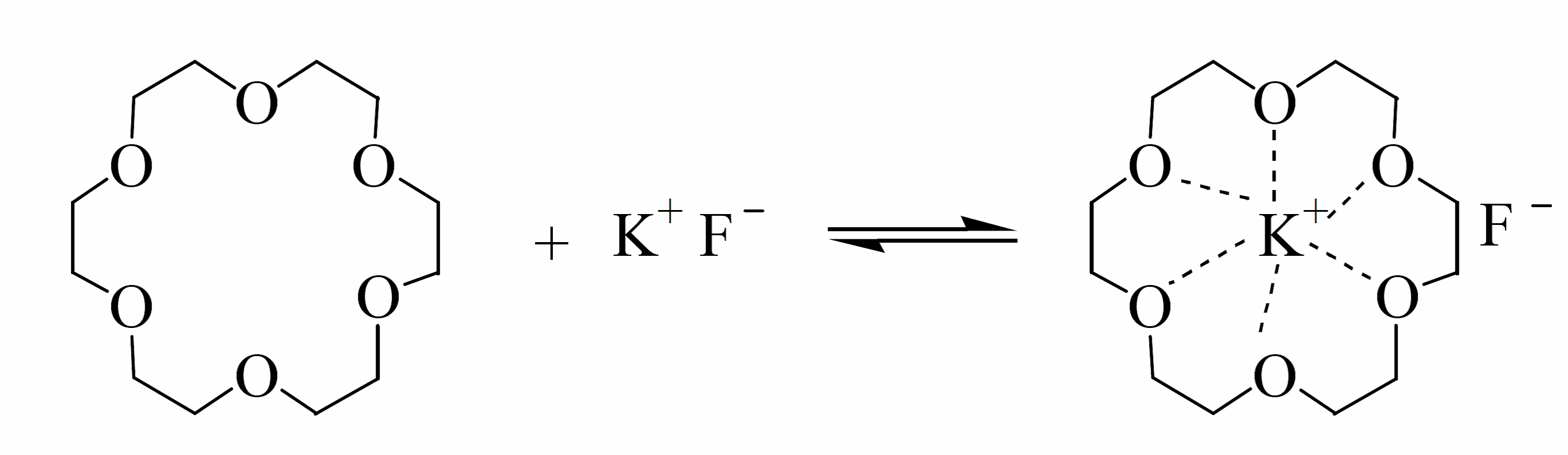Все реакции бимолекулярного замещения можно разбить на четыре типа в зависимости от состояния субстрата и нуклеофила, то есть, являются ли они нейтральными молекулами или заряженными частицами. Увеличение полярности растворителя (или диэлектрической проницаемости среды) по разному влияет на скорость $SN_2$ - реакции в зависимости от типа реакции:
В $SN_2$ - реакции (1), где субстрат и нуклеофил - нейтральные молекулы, повышение полярности среды приводит к увеличению скорости $SN_2$ - реакции, так как переходное состояние более полярное, чем исходное состояние. В остальных случаях (2-4) повышение полярности приводит к уменьшению скорости реакции, так как заряд в исходном состоянии более локальный и более сольватируется полярным растворителем (по теории Хьюза-Ингольда).
Зависимости скорости $SN_2$ реакций от природы растворителя
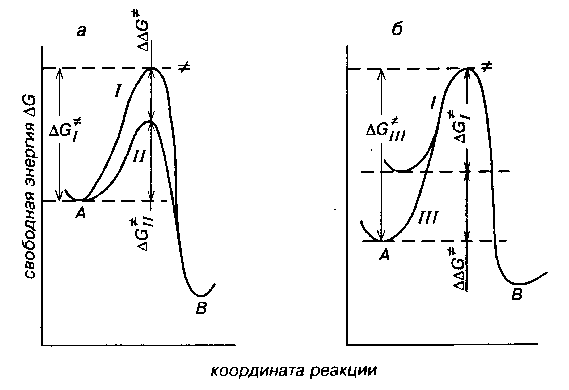
Скорости реакций определяются величинами свободных энергий активаций $\triangle G$, которые равны разностям свободных энергий исходных реагентов и переходноых состояний.
Чем меньше величины $\triangle G$, тем скорости больше. В растворах исходные реагенты и переходные соединения стабилизируются в различной степени в зависимости от сольватирующей способности растворителя. Различие в сольватации исходных и переходных состояниях в разных растворителях приводит либо к ускорению, либо к замедлению реакций (рис. 1).
Кривая I отражает изменение $\triangle G$ в условных жидких средах, где ни исходное соединение, ни переходные состояния не сольватированы. Кривая II соответствует случаям, когда сольватированы только переходные состояния. Это приводит к уменьшению величин $\triangle G$ и, следовательно, к ускорению реакций. Если сольватировано только исходное вещество (кривая III), то свободные энергии активации $\triangle G$ будут возрастать, что приведет к замедлению реакций. В реальных жидкостях сольватирован и исходный реагент, и переходные соединения, и скорости реакций определяются разностью свободных энергий сольватации этих частиц.
Проблему влияния растворителей на скорости реакций можно свести к определению свободной энергии сольватации исходного реагента и пере-ходного соединения. Точные количественные определения этих величин затруднительны и выполнены только для очень ограниченного числа процессов.
Рис. 1. Энергетический профиль реакций:
- а — с несольватированными (I) и сольватированными (II) переходными состояниями;
- б — с несольватированны и (I) и сольватированным (III) исходны реагентом. $\triangle G_I$; $\triangle G_{II}$ и $\triangle G_{III}$ — показатели свободной энергии активации реакции для растворителя I, II и III; А — исходный реагент; переходное состояние; В— конечный продукт.
Зависимости скорости $SN_2$ реакций от взаимодействия растворителя и нуклеофила
Однако на скорость $SN_2$ - реакции оказывает влияние не столько неспецифическая сольватация, сколько специфическая сольватация нуклеофила. В присутствии протонных растворителей между нуклеофилом- анионом и растворителем образуются водородные связи и нуклеофильная сила аниона резко уменьшается, причем, чем меньше по размерам анион, тем сильнее он специфически сольватируется протонным растворителем.
Например, относительная скорость реакции ($K_{отн}$)
$CH_3I + Cl^- -> CH_3Cl + I^-$
зависит от типа растворителя:
Увеличение скорости $SN_2$ при использовании диметилформамидов в качестве растворителей связано с исчезновением специфической сольватации хлорид иона, так как диметилформамид и диметилацетамид не способны образовывать водородные связи.
Таким образом, уменьшение специфической сольватации нуклеофила является главной причиной ускорения реакции бимолекулярного замещения типа анион-молекула в апротонных биполярных растворителях. Причем, чем более основен и меньше по размерам анион, тем лучше он сольватируется в протонных растворителях и тем с большей скоростью идет реакция в апротонных растворителях.
Следует отметить, что большие и сильно поляризуемые анионы достаточно хорошо сольватируются апротонными растворителями за счет неспецифической (дисперсионной) сольватации.
$SN_2$ - реакция в системе молекула - молекула также ускоряется апротонными биполярными растворителями. В этом случае, переходное состояние обладает сильно делокализованным зарядом и высоко поляризуемо, поэтому оно сольватируется апротонными бимолекулярными растворителями за счет дисперсионных сил.
Из вышеизложенного можно сделать вывод, что тип растворителя влияет на реакционную способность нуклеофила.
Например, относительная нуклеофильность галогенид-анионов в протонных растворителях изменяется в следующем порядке:
$F^-
а в апротонных растворителях порядок меняется на обратный.
Приемы для ускорения $SN_2$ реакций
Нуклеофил в растворителе может находиться в виде ионов или ионных пар. Связывание нуклеофила в ионную пару уменьшает его реакционную способность, то есть приводит к уменьшению скорости реакции.
Наиболее вероятно образуются ионные пары с меньшими размерами катионов и анионов.
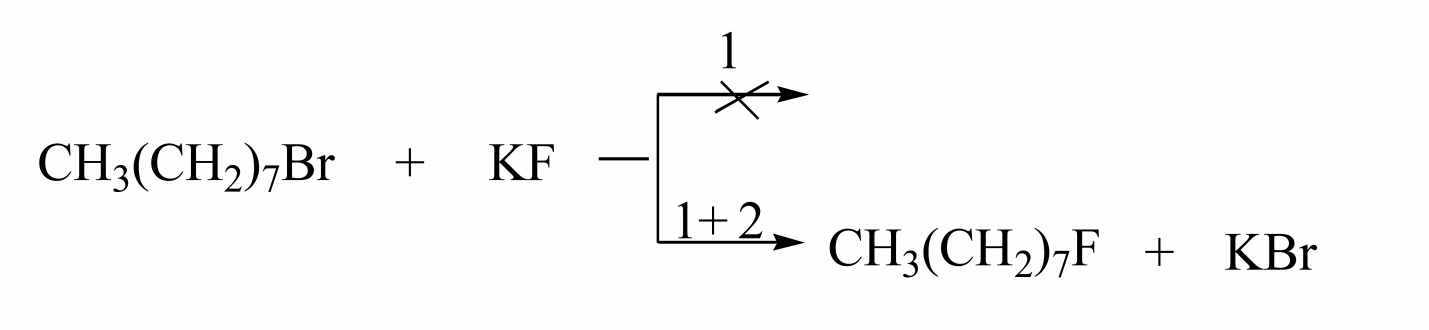
Для разрушения ионных пар с целью повышения скорости $SN_2$ - реакций используются краун-эфиры. Добавка краун-эфира повышает растворимость солей в неполярных растворителях.
Например, в присутствии [18]-краун-6 фторид калия растворяется в бензоле, так как краун-эфир специфически сольватирует катион $K^+$:
Анион фтора не сольватирован и действует как активный нуклеофил. В присутствии краун-эфиров (2) можно осуществлять реакции, которые в его отсутствии не идут, например, реакция октилбромида с $KF$ в бензоле (1).
Нагревание реакционных смесей увеличивает скорости $SN_2$ - реакций, однако при повышении температуры идет побочная реакция - образование олефинов по $E2$. Применение краун-эфиров позволяет проводить реакции в более мягких условиях.