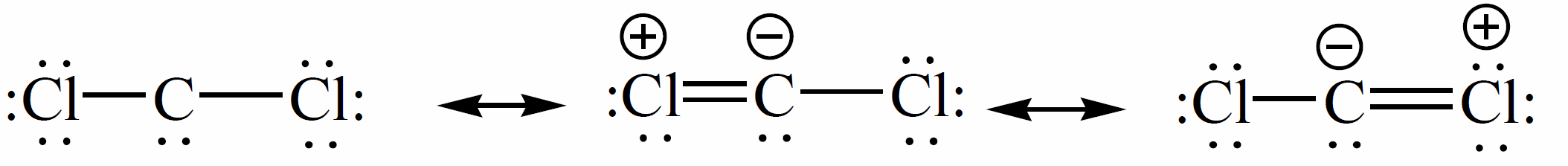
Карбены в своем составе имеют две одинарные $\sigma$-связи и шесть внешних электронов у атома углерода. Два несвязанных электрона в карбенах могут быть или спаренные или неспаренными. Спаренные электроны дают в ЭПР-спектре синглет, тогда два неспаренные, с параллельными спинами - триплет. В результате каждый карбен существует в двух электронных формах - триплетной и синглетной, одна из них представляет собой стационарную форму, другая - возбужденное состояние карбена.
Синглетные и триплетные формы карбенов различают по стабильности, энергией, реакционной способностью. Расчет по методу молекулярных орбиталей показывает, что разность энергий синглетного и триплетного карбенов составляет $9^{-11}$ ккал/моль. Для метилена, алкилкарбенов, арилкарбенов, ацилкарбенов, алкоксикарбонилкарбенов устойчива триплетная форма и она является основной для них. Менее стабильная, синглетная форма будет для этих соединений - возбужденным состоянием. Напротив, дигалогенкарбены и алкоксикарбены в основном состоянии – синглетные частицы, а в возбужденном - триплетные.
Экспериментально установлено, что сам метилен обычно образуется как синглетная частица, превращается в триплетную с меньшей энергией. Синглетный метилен, сталкиваясь с молекулами вокруг, отдает свою энергию и превращается в устойчивую триплетного форму. Синглетный дихлоркарбен образуется при дегидрохлорирования хлороформа. В отличие от синглетного метилена синглетный дихлоркарбен представляет собой стабильную частицу по сравнению с триплетным изомером. Очевидно, это можно объяснить переходом электронной пары от атома хлора на вакантную орбиталь атома углерода:
Доказательством стабильности синглетного дихлоркарбена является его инертность в реакциях внедрения в газовой фазе.
Теоретический и квантовохимический анализ строения карбенов
Определение геометрического строения карбенов представляет собой сложную задачу.
В большинстве структурных исследований карбенов и их аналогов геометрия подбирается из условия наилучшего соответствия экспериментально наблюдаемым характеристикам типа колебательно-вращательной структуры электронного спектра.
В этой связи особое значение приобретает использование для определения геометрического строения нескольких независимых методов. Для большинства простейших карбенов и их аналогов эта задача успешно решена, причем данные различных методов не только хорошо согласуются между собой, но и позволяют построить общую феноменологическую модель электронного и геометрического строения карбенов и их аналогов.
Карбены и их ближайшие аналоги по подгруппе IVB, образуя только две связи с заместителями, имеют две несвязывающие орбитали, заселенные двумя электронами. Простая, на первый взгляд, задача о распределении двух электронов по двум МО не имеет однозначного решения, и своеобразие строения и реакционной способности карбенов в большой мере основывается именно на различных вариантах заселения.
Синглетное и триплетное состояния карбенов
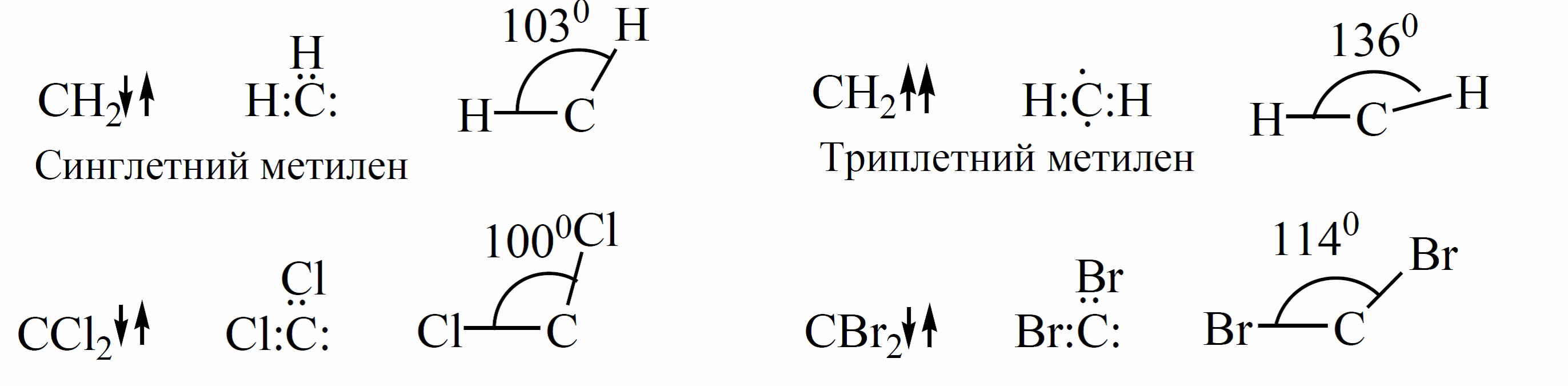
Карбены могут находиться в двух состояниях — синглетном и триплетном. В синглетном состоянии оба электрона обладают антипараллельнымн спинами, а в триплетном — они параллельны:
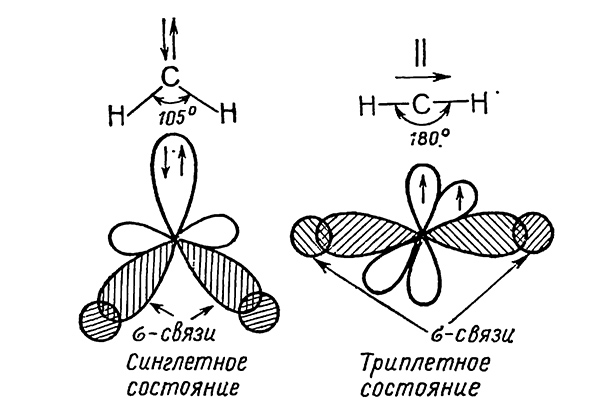
Триплетное (бирадикальное) состояние является основным. Атом углерода находится в состоянии $sp$-гибридизации, каждая из гибридных орбиталей используется для образования $С—Н$-связи, а оба неспаренных электрона с параллельными спинами занимают свободные р-орбитали. Триплетный метилен имеет линейное строение.
В синглетном состоянии углерод находится в состоянии $sp^2$-гибридизации, и две $sp^2$-орбитали используются для образования $С—Н$-связей, третью занимает пара электронов с антипараллель ными спинами, четвертая орбиталь вакантна. Вследствие взаимного отталкивания электронов синглетное состояние менее устойчиво, чем триплетное. В синглетном метилене угол, образованный направлением связей $Н—С—Н$ равен 105°.
Строение метилена
В синглетном метилене с $sp^2$-гибридизацией оба спаренных электрона расположены на гибридной орбитали. В триплетной форме наблюдают $sp$-гибридизацию, свободные неспаренных электрона расположены на двух негибридных $р$-орбиталях, такая частица представляет собой бирадикал. В триплетном состоянии уменьшается взаимное отталкивание электронов из-за того, что они расположены на р-орбиталях с различными спинами.
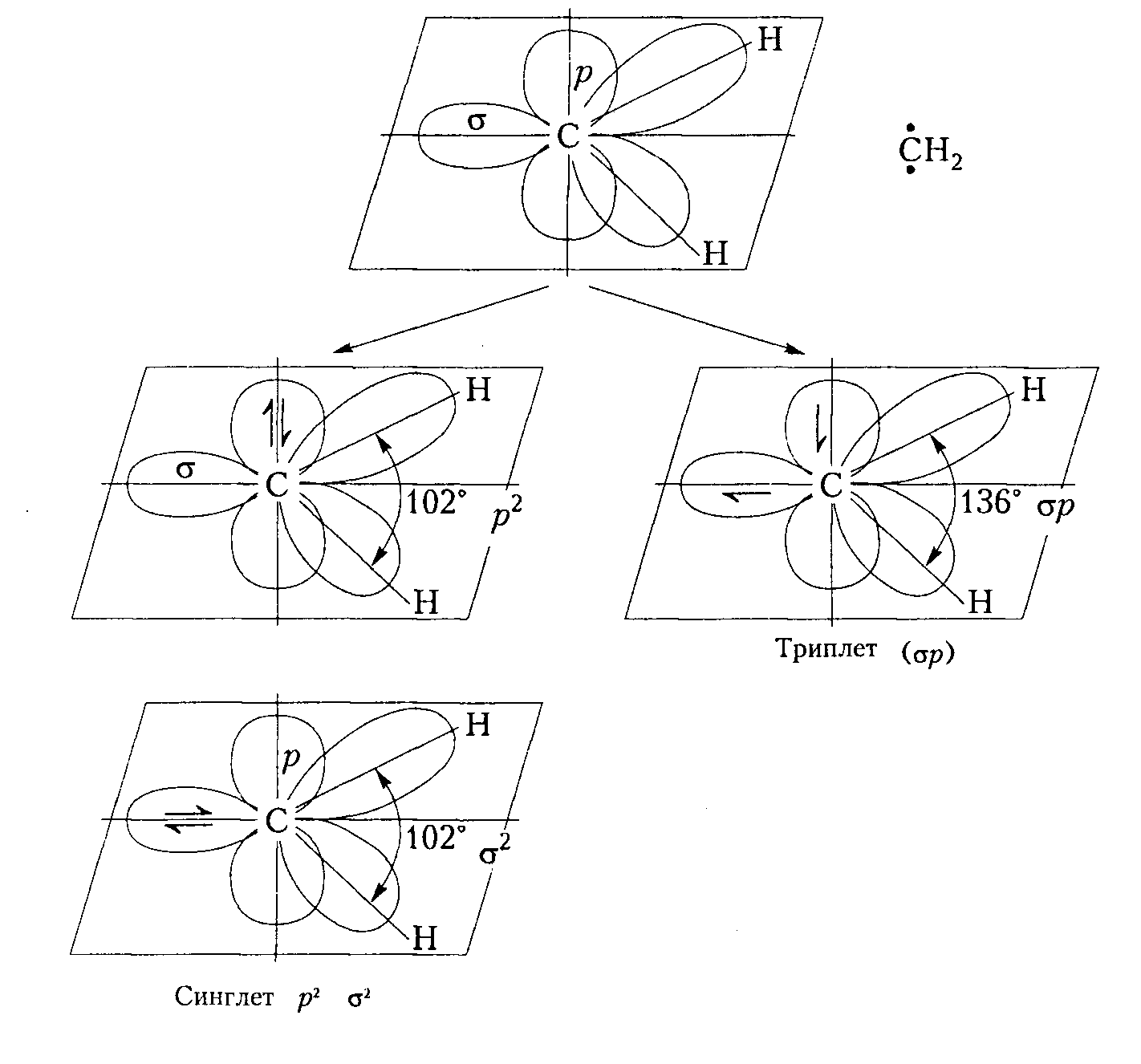
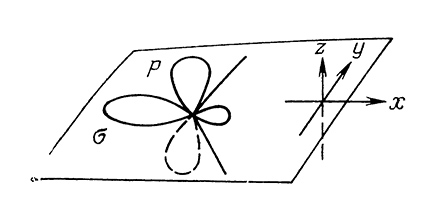
Результаты ИК, ЭПР-спектроскопии, а также расчеты по методу молекулярных орбиталей убеждают, что карбен $:CH_2$ в невозбужденном состоянии существует в виде деформированной (скошенной) конфигурации плоского строения с двумя несвязующими орбиталями: $σ$ орбиталь имеет значительный $p$-характер и находится в плоскости молекулы; р-орбиталь расположена перпендикулярно к этой плоскости.
В основном синглетном состоянии два свободных электрона спаренные и расположены на одной из орбиталей - на $\sigma$- (состояние $\sigma^2$) ) или на $p-AO$ (состояние $p^2$):
При расположении неспаренных электронов на разных орбиталях с одинаковыми знаками спина имеет место основное триплетное состояние ($\sigma p$). В пользу этого свидетельствует то, что триплетное состояние дает сигнал в спектрах ЭПР, а синглетное - нет. Кроме того, триплетное состояние примерно на 45 кДж/моль стабильнее, то есть имеет более низкую энергию, чем синглетное. Это связано с большим отталкиванием спаренных электронов $\sigma$- или $p$-орбиталей и электронов, связей друг от друга в синглетном состоянии по сравнению с триплетным. В триплетном состоянии находятся также алкильные или арильные производные карбенов. Для дигалогенокарбенов ($:CCl_2$) стабильным считают синглетное состояние.