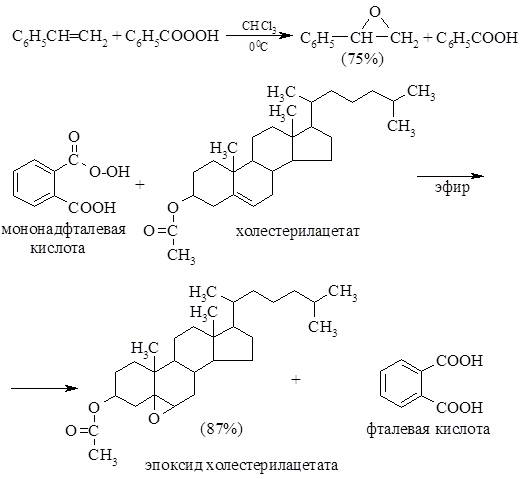
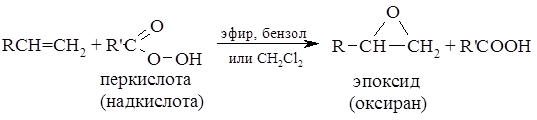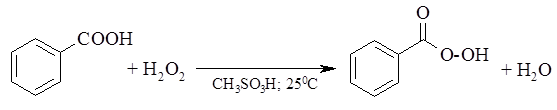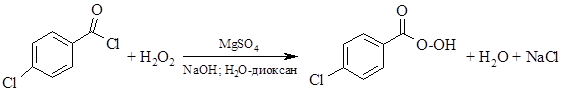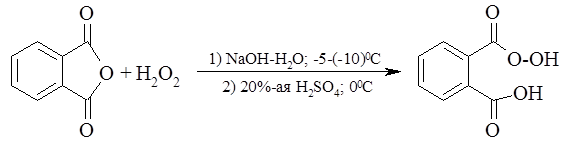Эпоксидирование олефинов проводят с помощью любой из ряда перкислот, из которых наиболее часто используют хлорпербензойную кислоту. Эта реакция, называемая реакцией Прилежаева, находит широкое применение. Реакции не мешают алкильные, арильные, гидроксильные, сложноэфирные и другие группы, но суострат не должен содержать аминогрупп, так как с ними взаимодействует реагент. Электронодонорные заместители повышают скорость реакции, особенно быстро реакция протекает с тетраалкил олефинами. Процесс проводят в мягких условиях с высокими выходами. Используются и другие перкислоты, в частности перуксусная и пербензойная. Повышенной реакционной способностью отличаются трифторопер- уксусная кислота и 2,5-динитропербензойная.
Эпоксидирование двойной связи С—С часто используют для введения в органическую молекулу атома кислорода. Эту реакцию, протекающую с помощью органического гидропероксида $RCOOOH$, можно рассматривать как присоединение электрофила (атома кислорода) по двойной связи. Реакционноспособиость гидропероксидов возрастает с ростом кислотности. Электрофильное присоединение происходит с наименее про-странственно-затрудненной стороны (стереоселективность процесса). Наиболее электроноизбыточной является наиболее замещенная двойная связь, именно она и подвергается зпоксидированию.
Согласно современно номенклатуре ИЮПАК, трехчленный цикл с одним атомом кислорода носит название оксиран.
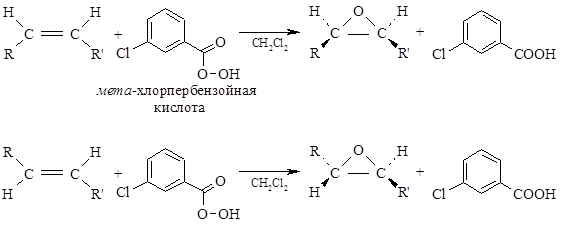
В качестве эпоксидирующих агентов используются перкислоты: пербензойная, м-хлорпербензойная, мононадфталевая, перуксусная, пертрифторуксусная и пермуравьиная. Перкислоты ароматического ряда применяют в виде индивидуальных реагентов, тогда как перкислоты алифатического ряда $– CH_3CO_3H, CF_3CO_3H и HCO_3H$ – не выделяют индивидуально и используют сразу после их образования при взаимодействии 30- или 90%-й перекиси водорода и соответствующей карбоновой кислоты. Пербензойную и мета-хлорпербензойную кислоты в настоящее время получают окислением соответственно бензойной и мета-хлорбензойной кислот 70%-й перкисью водорода в растворе метансульфокислоты:
или из хлорангидридов кислот и перекиси водорода:
Мононадфталевую кислоту получают подобным методом из фталевого ангидрида и 30%-й перекиси водорода в водной щелочи:
Первоначально для получения оксиранов (эпоксидов) использовалась пербензойная или мононадфталевая кислоты:
Механизм эпоксидирования
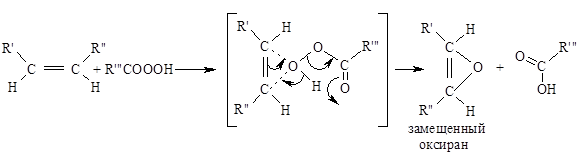
Эпоксидирование алкенов следует рассматривать как синхронный, согласованный процесс, в котором не участвуют ионные интермедиаты типа гидроксильного катиона $OH^+$. Эпоксидирование алкенов представляет собой процесс син-присоединения одного атома кислорода по двойной связи с полным сохранением конфигурации заместителей при двойной связи:
Для эпоксидирования был предложен механизм, характерный для согласованных процессов:
В пользу этого механизма свидетельствуют следующие факты:
- Реакция имеет второй порядок. Если бы лимитирующей стадией была ионизация, то реакция имела бы первый порядок по перкислоте.
- Взаимодействие легко происходит в неполярных растворителях, которые не способствуют образованию ионов.
- Исследование влияния изменений в структуре субстрата на скорость реакции показывает, что переходное состояние не носит карбокатионного характера.
- Присоединение идет стереоспецифично, т. е. из транс-олефина получается транс-эпоксид, а из цис-олефина— цис-эпоксид.
Селективность при эпоксидировании
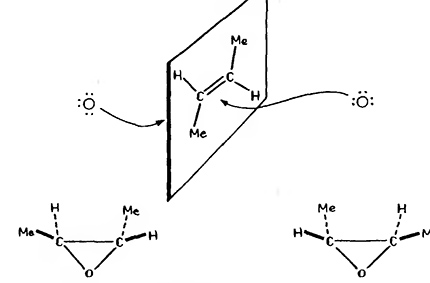
- Стереоселективность. Двойная связь норборнена (бицикло[2.2.1]гептен) более доступна с выпуклой экзо-стороны, чем с вогнутой эндо-стороны. Последняя до некоторой степени экранирована связями $C(5)—H$ и $C(6)—H$. Эпоксидирование приводит к образованию 99% экзо-эпоксида и менее 1% эндо-изомера . Достаточно блокировать экзо-сторону метальной группой в син-положении (7), чтобы понизить стереоселективность до 90% эндо-изомера.
- Региоселективность. Этиленовые связи обогащены электронами благодаря сверхсо- пряжеиию. Наиболее богатые электронами связи в то же время и легче всего замещаются. Лимонен, содержащий двойную связь с двумя заместителями вне цикла и двойную тризамещенную связь в цикле, селективно эпоксидируется по этой последней связи. Бис-циклогексадиен-1,4, являющийся продуктом восстановления нафталина по Бёрчу, селективно эпоксидируется по тетразамещеиной двойной связи.
- Энантиоселективность по Шарплессу. В зависимости от того, какая из сторон транс-бутена атакуется электрофильным атомом кислорода, образуется эпоксид R,R- или 8,8-коифигурации. Энантиоселективность проявляется в том, чтобы выход того или иного энантиомера был как можно большим.
Идея состоит в том, чтобы использовать группу $OH$ при одном из аллильиых атомов углерода в качестве носителя. Эта группа направляет эпоксидирование преимущественно в ту или иную сторону, и, следовательно, образующиеся эпоксиды будут стереоизомерами. Действительно, применение трет-бутилгидропероксида в присутствии V5+ в качестве катализатора позволяет добиться пероксидного окисления с очень большим преобладанием (до 98%) продукта, в котором две кислородсодержащие функциональные группы находятся в одном и том же полупространстве.