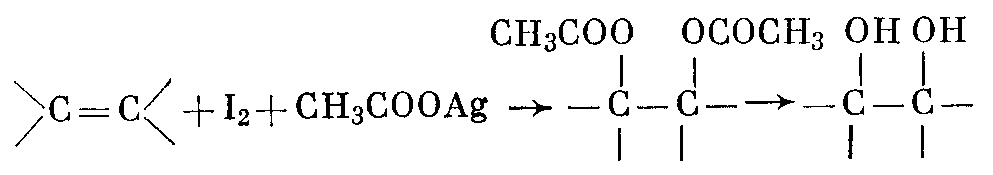Окисление алкенов по связи $С=С$ может протекать очень легко под действием различных реагентов. Этого вполне следовало ожидать точно в такой же мере, в какой не удивительна трудность некаталитического восстановления алкенов. Некаталитическое восстановление обычно протекает либо как нуклеофильная атака гидрид-иона, а реакции этого типа с трудом осуществимы для алкенов, либо за счет образования дианиона, причем отрицательные заряды в этом случае оказываются на соседних атомах углерода. В то же время окисление являющееся по сути электрофильной реакцией, может легко протекать по легкодоступным и относительно подвижным π-электронам связи $С = С$.
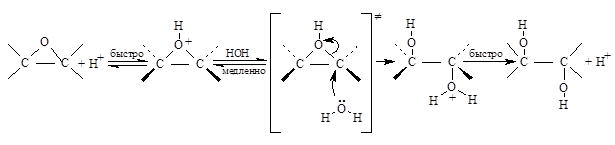
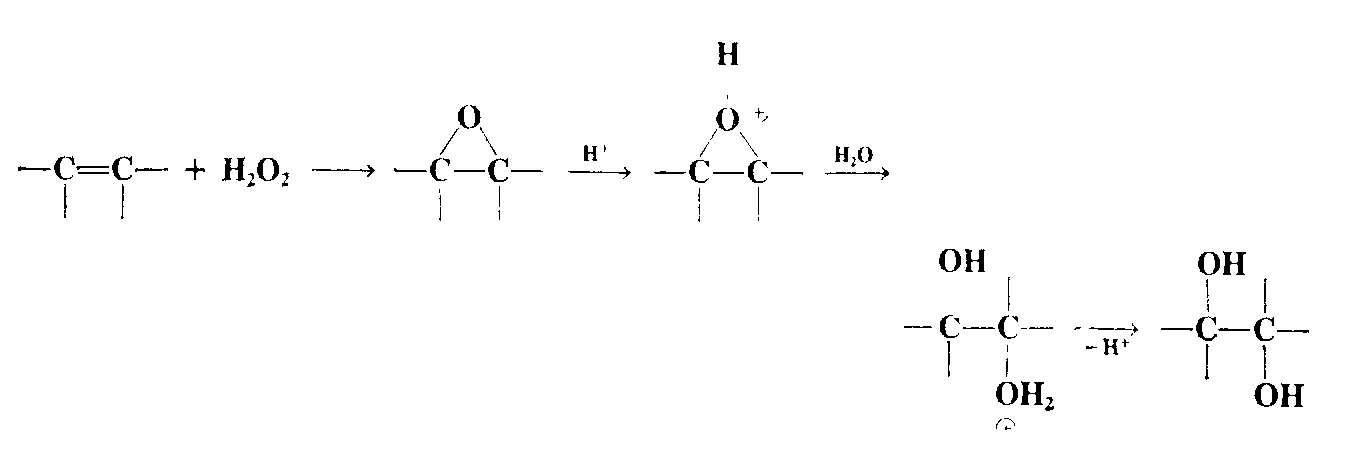
В результате действия перкислот на алкены образуются оксираны трехчленных циклов с одним атомом кислорода – уже рассмотренная ранее реакция эпоксидирования. Трехчленное кольцо оксиранов легко раскрывается под действием самых разнообразных нуклеофильных реагентов. В случае гидролиза эпоксидов, который катализируется как кислотами, так и основаниями, образуются вицинальные диолы, т.е. гликоли. При кислотном катализе в первой стадии происходит протонирование атома кислорода эпоксида с образованием циклического оксониевого иона, который раскрывается в результате нуклеофильной атаки молекулы воды:
Реакция Прилежаева
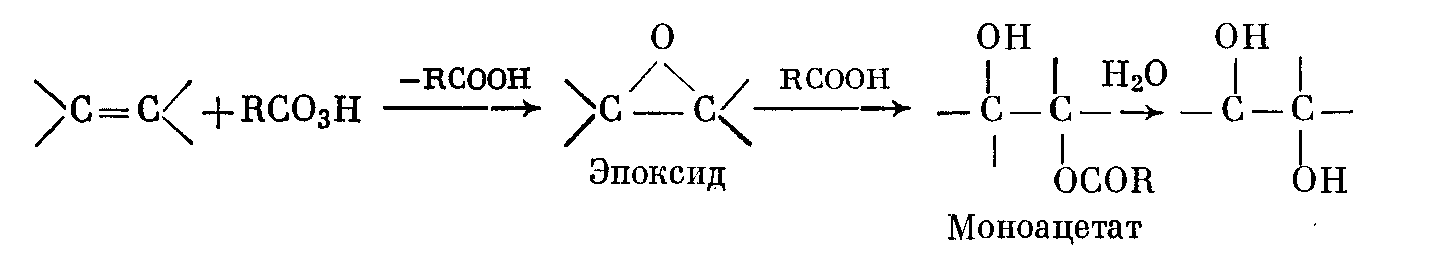
Известен ряд реагентов транс-гидроксилирования алкенов. В реакции Прилежаева надкислоты ведут себя не как просто кислоты, а как окисляющие агенты, атакующие $\pi$-связь алкена с образованием эпокиси(1,2-эпоксиалкана). В соответствующих условиях, например в безводном инертном растворителе, таком, как эфир или бензол, это соединение может быть выделено; в других условиях эпокись будет превращаться в моноэфир, гидролиз которого будет давать диол. Так, надуксусная кислота, получаемая при реакции перекиси водорода с уксусной кислотой, превращает алкен в моноацетат соответствующего диола, который при гидролизе дает диол:
Кроме надуксусной кислоты, часто используются следующие надкислоты: надмуравьиная (образуемая из перекиси водорода и муравьиной кислоты) и относительно устойчивые надбензойная и трифторнадуксусная $CF_3CO_3H$. Последние два реагента чаще применяют тогда, когда целью является получение эпоксипродукта, но, по-видимому, трифторнадуксусная кислота наиболее эффективный и универсальный реагент.
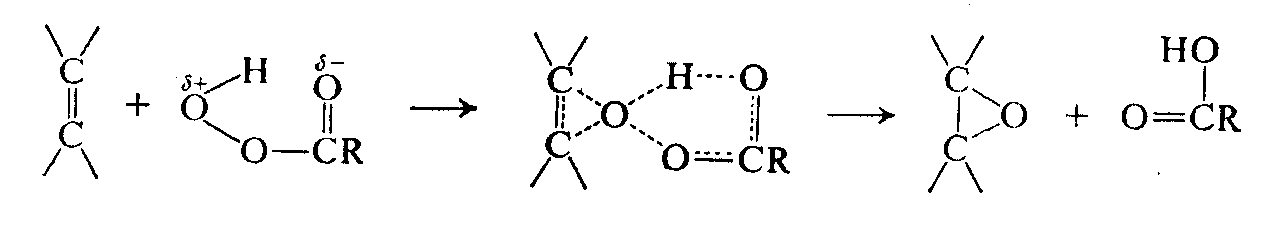
Если рассмотреть механизм эпоксидирования, то станет ясной причина повышенной активности трифторнадуксусной кислоты. Действие надкислот основано на полярности связи $О — О$, причем электрофильная реакция инициируется за счет атаки относительно положительного атома кислорода.
Наличие трех мощных электроноакцепторных атомов фтора в группе R должно резко увеличивать положительный заряд на этом атоме кислорода, а следовательно, и его электрофильность:
Следовательно, двухстадийный процесс эпоксидирования алкенов с последующим щелочным гидролизом эпоксидов является реакцией антигидроксилирования алкенов.
Другие методы анти-гидроксилирования
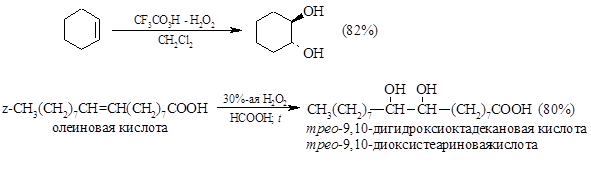
Анти-Гидроксилирование можно осуществить при действии $H_2O_2$ и муравьиной кислоты. В этом случае сначала идет эпоксидирование, а затем — реакция $Sn_2$, что в итоге дает анти-присоединение:
Условность термина «окисление» в применении к цис- или транс-гидроксилированию наглядно видна из того факта, что те же суммарные результаты могут быть получены при действии реагентов, вызывающих реакции присоединения и замещения. Так, реагент Прево (йод и ацетат серебра) приводит к образованию диацильного производного, гидролиз которого дает диол:
Реакция Прево
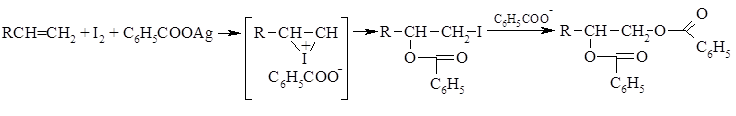
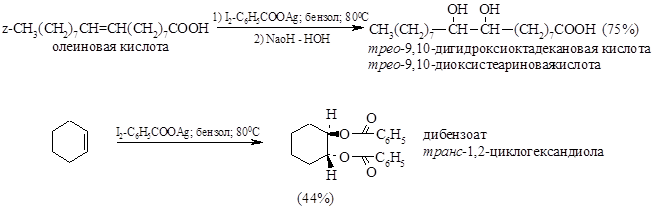
Метод анти-гидроксилирования алкенов был предложен и разработан К. Прево (1933 г.). Алкен нагревают с йодом и бензоатом или ацетатом серебра в безводном бензоле или $CCl_4$. транс-Присоединение к двойной связи первоначально приводит к образованию йодэфира, в котором йод далее замещается бензоат-ионом, и получается дибензоат гликоля:
При использовании моноперянтарной кислоты можно добиться того же результата в одну стадию. Общее анти-присоединение можно провести по методу Прево. По этому методу олефин обрабатывают йодом и бензоатом серебра, взятыми в молярном соотношении 1:2. Первоначально происходит анти-присоединение, что дает $\beta$-галогенозамещенный бензоат. Это соединение можно выделить, поэтому реакция представляет собой присоединение $IOCOPh$. Однако в обычных условиях проведения реакции атом йода замещается на вторую группу $PhCOO$. Это реакция нуклеофильного замещения, идущая по механизму с участием соседней группы, поэтому сохраняется взаимное анти-расположение этих групп.
Реакция Прево в безводной среде приводит к образованию того же диола, что и эпоксидирование алкенов с последующим гидролизом:
Если применять реагент Прево в безводном растворителе, например в четыреххлористом углероде, то осуществляется пгракс-ацетоксилирование, и, следовательно, может быть получен транс-диол, в то время как цис-гидроксилирование может быть осуществлено, если растворителем является влажная уксусная кислота.