Эффекты заместителей в органических молекулах
Для полного понимания механизма реакции необходимо рассмотреть влияние заместителей в молекулах органических веществ на предэкспоненциальный множитель, скорость и энергию активации. Также они оказывают влияние на распределение электронной плотности в молекуле.
Если атом играет роль реакционного центра в молекуле, то введение заместителя в структуру молекулы будет способствовать увеличению электронной плотности у этого атома. Что, в свою очередь, способствует понижению энергии активации и увеличению скорости химической реакции.
При введении метильной группы в молекулу пиридина происходит увеличение электронной плотности на атоме азота, что делает его более реакционноспособным. Скорость реакции метилпиридина с метилиодидом будет выше, чем реакции пиридина.
Индуктивный эффект - смещение электронов без изменения химических связей вдоль цепи атомов.
Электромерный эффект - неравномерное распределение электронной плотности при наличии в молекуле двойных сопряженных связей.
На определенных атомах в молекулах электронная плотность в ходе реакции может изменяться.
Уравнение Гаммета
В некоторых случаях влияние заместителей на скорость реакции описывается уравнением Гаммета.
Согласно этому уравнению, логарифмы констант скоростей, протекающих в боковых цепях или логарифмы констант равновесий реакций, затрагивающих боковую цепь, линейно связаны с константами ионизации соответствующих бензойных кислот, имеющих те же заместители.
На рис.1 отображены линейные зависимости, включающие мета- и пара- производные бензола. Величина и знак наклона являются важными характеристиками реакции. На установление связи между строением и реакционной способностью может указывать даже характер отклонений.
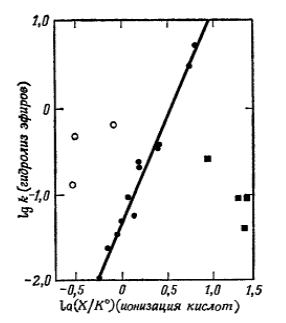
Рисунок 1. Константы ионизации карбоновых кислот с удельными скоростями гидролиза их эфиров. черные точки - мета- и пара- замещенные бензойные кислоты, черные квадраты - орто-замещение бензойной кислоты, белые точки - алифатические кислоты.
Две серии констант скоростей или равновесий находятся в линейной зависимости как между собой, так и линейно зависят от третьей серии. Поэтому разные серии можно связать между собой с помощью одной, выбранной в качестве стандарта.
Наиболее удобно в качестве стандарта брать константы ионизации замещенных бензойных кислот в воде при $25^\circ C$ (Рис. 2).
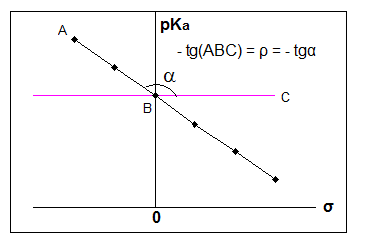
Рисунок 2. Зависимость Гаммета для замещенных бензойных кислот
Заместитель $i$ можно охарактеризовать константой $\sigma i$, которую определяем из выражения
где $K_0$- константа ионизации бензойной кислоты;
$K_i$- константа ионизации замещенной бензойной кислоты.
Линейная зависимость свободных энергий и является, собственно, уравнением Гаммета:
где $k_{ij}$- константа скорости или равновесия реакции $j$ при наличии заместителя $i$;
$k_{0j}$- предыдущая константа в отсутствии заместителя.
Параметр ${\rho }_j$ является реакционной константой реакции $i.$
Используя уравнение Гаммета можно вычислить реакционную константу реакции и подставив значение $lgk_{ij}$ для заместителя, найти значение неизвестной $\sigma_i$- константы, при условии, что известны данные по влиянию достаточно большого числа заместителей.
Пространственные эффекты
Отклонение точек, соответствующих алифатическим соединениям и орто-производным бензола, от прямой, созданной для мета- и пара-производных, объясняют специфическими пространственными короткодействующими взаимодействиями.
Если реакционный центр удален на более-менее значительное расстояние от участка молекулы, в котором наблюдаются структурные изменения, то отклонения исчезнут.
Существует зависимость между удельной скоростью реакции $(I)$ в метаноле при $100^\circ C$
\[RCOOCH_3 + N(CH_3)_3 → RCOO^- + N(CH_3)_{4+}\]и константами равновесия реакции $(II)$ в воде при такой же температуре
\[RCOOH + H_2O ↔ RCOO^- + H_3O^+.\]Стандартное отклонение точек от прямой составило $0,1$ (Рис. 3).
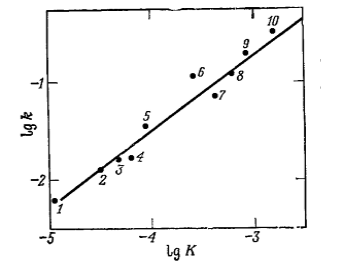
Рисунок 3. Корреляция удельных скоростей метиловых эфиров карбоновых кислот с триметиламином с константами кислотности карбоновых кислот. Кислоты: 1 - уксусная, 2 -- $n$-толуиловая, 3 -- бензойная, 4 -- $o$- толуиловая, 5 -- молочная, 6 -- $n$ -- нитробензойная, 7 -- $o$-- хлорбензойная, 8 -- фталевая, 9 -- салициловая, 10 - $o$ -- нитробензойная
$lgk$ для реакции $(I)$ связан с $lgk$ для реакции $(II)$ линейно. При этом корреляция затрагивает как олифатические, так и ароматические эфиры.
В вероятном переходном состоянии
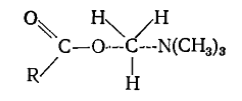
Рисунок 4.
реакционный центр удален от группы $R$ на большее расстояние по сравнению с углеродом карбоксила, который, в свою очередь, является реакционным центром при гидролизе эфиров.











