Катализатор и его каталитическая активность
Одним из важнейших вопросов катализа является проблема взаимосвязи электронного строения катализатора с его каталитической активностью.
В кислотно -- основном катализе параметром, отражающим электронное строение, выступает величина $pK_a$ катализатора.
Бренстед и Педерсен вывели соотношение, показывающее связь между катализатором и катализируемыми им реакциями на примере разложения нитрамида:
Для данной реакции характерна линейная корреляция между логарифмом константы скорости и величиной $pK_a$ основания. И нитрамид и все рассмотренные Бренстедом основания были «жесткими». Поэтому вероятность нахождения протона в переходном состоянии ближе к основанию, чем к кислоте, маловероятна.
Бренстед установил, что чем сильнее основание (или кислота), тем оно эффективнее как общий основной (кислотный) катализатор.
Каталитический закон Бренстеда можно представить через:
-
константу скорости реакции кислоты
\[k_A=G_AK^{\alpha }_a,\]где индексы $A$ и $\alpha $ характеризуют кислоту, а $G$ - константа.
-
константу скорости реакции основания
\[k_B=G_B(\frac{1}{K_a})^{\beta },\]где индексы В и $\beta $ характеризуют основание, а $K_a$-- константа диссоциации кислоты $A$ или кислоты, сопряженной с основанием $B$.
Полученные уравнения можно представить в линейной логарифмической форме:
где $k_A$ и $k_B$ --константы скорости реакций, катализируемых кислотами и основаниями;
$K_a(AH)$ и $K_a(BH^+)$ -- константы диссоциации катализаторов;
$\alpha $ и $\beta $ -- коэффициенты Бренстеда.
Зависимость $logk_A$ от $pK_a$ -- линейная с наклоном - $\alpha $; зависимость $logk_B$ от $pK_a$ - линейная с наклоном + $\beta $.
Катализ реакции разложения нитрамида (Рис. 1). На графике можно наблюдать хорошую линейную корреляцию на протяжении трех единиц $pK$, а также около двух десятичных порядков по константе скорости. Наклон прямой линии $\beta $ равен $0,66.$
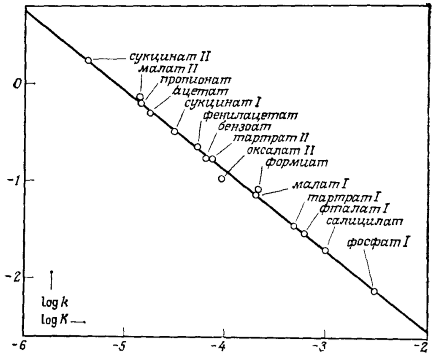
Рисунок 1. Катализ реакции разложения нитрамида
Если общие кислоты или основания содержат более одной ионизируемой группы, то константы ионизации испытывают взаимное влечение. Для анализа таких реакций вводят статистические поправки.
Линейные соотношения Бренстеда
Линейные соотношения Бренстеда справедливы для каталитических реакций, которые протекают если:
- в качестве реагентов или катализаторов выступают кислород- или азотсодержащие кислоты или основания;
- значения констант скоростей меньше, чем диффузионный предел.
Случаи нарушения линейности и другие отклонения от соотношения Бренстеда:
- в качестве реагентов или катализаторов выступают карбокислоты или карбоснования;
- константы скорости близки к диффузионному пределу;
- если структурные изменения в молекуле или сольватной оболочке влияют на кинетику протонного переноса;
- если реакции катализируются первичными, вторичными, третичными аминами (причины: пространственная деформация, различия в сольватации, специфические сольватационные эффекты, стерические затруднения в молекуле субстрата или катализатора, изменение механизма реакции).
Примеры реакций, подчиняющихся закону Бренстеда, приведены в табл.1.
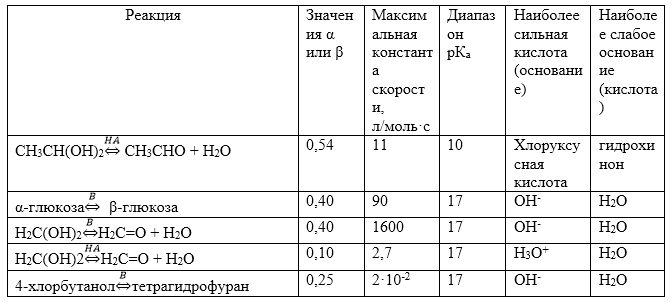
Рисунок 2. Некоторые линейные соотношения Бренстеда
Смысл каталитического уравнения Бренстеда
Бренстед предположил существование взаимосвязи между константой скорости реакции и константой равновесия лимитирующей стадии переноса протона.
Для общего основного катализа уравнение Бренстеда имеет вид:
Если прологарифмировать уравнение
получим
тогда
Так как последние три члена постоянны, уравнение можно представить в виде
Между логарифмами константы скоростей и константы равновесия существует линейная зависимость для простых систем.
Для объяснения уравнения Бренстеда используют диаграммы молекулярной потенциальной энергии.
Если допустить, что перенос протона -- это трехцентровая реакция, вклад в энергию отталкивания вносит только взаимное влияние двух тяжелых атомов, которые неподвижны и отстоят друг от друга на фиксированном расстоянии, при этом протон перемещается между ними, то такую реакцию можно описать профилем потенциальной энергии (Рис. 3).
На диаграмме не отображены энергия отталкивания и резонансное взаимодействие, снижающее энергию переходного состояния.
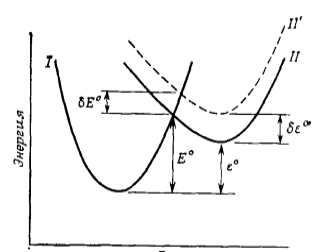
Рисунок 3. Профиль потенциальной энергии вдоль координаты реакции, иллюстрирующий молекулярную основу уравнения Бренстеда
Кривая $І$ описывает систему исходных веществ $SH + B$, где $SH$ - субстрат, $B$ - катализатор (основание).
Кривая $ІІ$ описывает систему $S^- + BH^+$. При этом энергия активации равна $Е^º$, а изменение свободной энергии в ходе реакции $\varepsilon^º$. Если в молекулу катализатора ввести заместитель, вызывающий уменьшение основных свойств, то кривая $ІІ$ переместится в положение $ІІ`$. Кривая $ІІ`$ будет смещена по оси энергии вверх.
Приращение $\delta $Е и $\delta \varepsilon^º$ связаны соотношением
где $S1$ и $S2$- наклоны двух прямых в точке пересечения.
Данное уравнение отображает каталитический закон Бренстеда.












